Hvad er arten af binding, der findes i kulstofforbindelser?
Her er hvorfor:
* Carbon's elektronkonfiguration: Carbon har 4 valenselektroner, hvilket betyder, at det har 4 elektroner i sin yderste skal. Det skal vinde eller miste 4 elektroner for at opnå en stabil oktetkonfiguration (8 elektroner i dens ydre skal).
* Deling af elektroner: Carbon opnår stabilitet ved deling Dens valenselektroner med andre atomer, der danner kovalente bindinger.
* Stærke obligationer: Kovalente bindinger er relativt stærke, hvilket fører til dannelse af stabile molekyler.
Eksempler:
* methan (CH4): Carbon deler en elektron med hvert af de fire hydrogenatomer, der danner fire enkelt kovalente bindinger.
* ethan (C2H6): Hvert carbonatom danner fire kovalente bindinger, tre med brintatomer og den ene med det andet carbonatom.
* kuldioxid (CO2): Carbon danner to dobbelt kovalente bindinger med to iltatomer.
Andre typer bindinger i kulstofforbindelser:
* ioniske bindinger: Mens de er mindre almindelige, kan ioniske bindinger forekomme i nogle kulstofforbindelser, der indeholder stærkt elektronegative elementer som ilt.
* Hydrogenbindinger: Hydrogenbindinger kan dannes mellem molekyler indeholdende brint- og elektronegative elementer som ilt. Disse bindinger er svagere end kovalente bindinger, men spiller betydelige roller i egenskaberne ved mange kulstofforbindelser.
Kortfattet: Kovalent binding er den dominerende type binding i kulstofforbindelser på grund af kulstofens evne til at danne stærke og stabile bindinger ved at dele elektroner med andre atomer. Dette fører til den enorme mangfoldighed og kompleksitet i organisk kemi.
 Varme artikler
Varme artikler
-
 Innovationspionerer scorer verdens først for bæredygtigt byggeri med grafenbetonTeam fra University of Manchester og Nationwide Engineering om verdens første konstruerede grafenbeton i kommercielle omgivelser, kun et par kilometer øst for det gamle monument i Stonehenge, det nye
Innovationspionerer scorer verdens først for bæredygtigt byggeri med grafenbetonTeam fra University of Manchester og Nationwide Engineering om verdens første konstruerede grafenbeton i kommercielle omgivelser, kun et par kilometer øst for det gamle monument i Stonehenge, det nye -
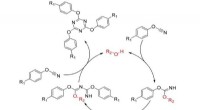 Kemikere tilbyder et nyt kig på polymerer til rumindustrienMekanisme for cyklotrimerisering af cyanatestere. Kredit:Kazan Federal University Medarbejdere ved Institut for Fysisk Kemi ved Kazan Federal University har fundet ud af, at mekanismerne til polym
Kemikere tilbyder et nyt kig på polymerer til rumindustrienMekanisme for cyklotrimerisering af cyanatestere. Kredit:Kazan Federal University Medarbejdere ved Institut for Fysisk Kemi ved Kazan Federal University har fundet ud af, at mekanismerne til polym -
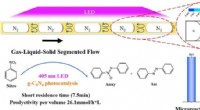 Forskere foreslår en ny metode til at forbedre heterogen fotosyntese af azoforbindelserKredit: Chemical Engineering Journal (2021). DOI:10.1016/j.cej.2021.130226 Fotokatalytiske reaktioner, som låser op for kemiske transformationer under milde forhold, der ikke er tilgængelige for
Forskere foreslår en ny metode til at forbedre heterogen fotosyntese af azoforbindelserKredit: Chemical Engineering Journal (2021). DOI:10.1016/j.cej.2021.130226 Fotokatalytiske reaktioner, som låser op for kemiske transformationer under milde forhold, der ikke er tilgængelige for -
 Flyveaske geopolymerbeton:Betydeligt forbedret modstandsdygtighed over for ekstremt alkaliangrebGeopolymer betonblokke, varmehærdet ved 200 grader Celsius og derefter nedsænket i et ekstremt alkalisk medium i 14 dage ved 80 grader Celsius (a og b), modstå angrebet væsentligt bedre end blokke var
Flyveaske geopolymerbeton:Betydeligt forbedret modstandsdygtighed over for ekstremt alkaliangrebGeopolymer betonblokke, varmehærdet ved 200 grader Celsius og derefter nedsænket i et ekstremt alkalisk medium i 14 dage ved 80 grader Celsius (a og b), modstå angrebet væsentligt bedre end blokke var
- Hvad er bindingen mellem gassens oxygenatomer?
- Hvilken Landform adskiller Mexico To hovedbjergeområder?
- Sydney ramlede af hagl på størrelse med tennisbolde
- Egypten siger landsby fundet i Nildeltaet forud for faraoer
- Hvad er brugen af en niveau titrering
- Leder:Beskyt Californias miljøarv mod Trumps angreb


