Hvordan fremstilles sulfat, og hvor kommer det fra?
1. Sulfation (so₄²⁻)
* Dette er en negativt ladet ion og er ikke fremstillet.
* Det findes naturligt i mange mineraler, især gips (caso₄ · 2H₂o) og anhydrit (caso₄) .
* Det er også en vigtig komponent i svovlsyre (H₂so₄) .
2. Sulfatsalte
* Disse er forbindelser dannet, når sulfationer kombineres med andre positive ioner (kationer).
* Eksempler inkluderer:
* Natriumsulfat (na₂so₄)
* Magnesiumsulfat (MGSO₄)
* Ammoniumsulfat ((NH₄) ₂SO₄)
* sulfatsalte kan fremstilles på forskellige måder afhængigt af det specifikke salt:
* fra naturlige kilder: Nogle sulfatsalte udvindes direkte fra aflejringer af mineraler som gips eller anhydrit.
* ved at reagere svovlsyre med andre stoffer: For eksempel kan natriumsulfat produceres ved at reagere svovlsyre med natriumchlorid (salt).
* fra industrielle processer: Nogle sulfatsalte er biprodukter af andre industrielle processer, som produktion af fosforsyre.
hvor kommer svovl fra?
* Det svovl, der bruges til at fremstille svovlsyre og sulfatsalte, kommer fra forskellige kilder:
* Elementær svovl: Udvindet fra underjordiske aflejringer.
* hydrogensulfid (H₂s): En naturgaskomponent ekstraherede og behandles ofte for at producere svovl.
* sulfidmineraler: Malm som pyrit (FES₂) behandles til ekstraktion af svovl.
Svovlsyrefremstilling:
* Den mest almindelige metode er kontaktprocessen:
1. svovl brændes i luft for at producere svovldioxid (SO₂).
2. svovldioxid oxideres til svovltrioxid (SO₃) ved anvendelse af en katalysator.
3. svovltrioxid opløses i vand for at producere svovlsyre (H₂so₄).
sulfatsalte kan derefter fremstilles ved at reagere svovlsyre med andre stoffer.
I resumé forekommer sulfationer naturligt, og sulfatsalte kan fremstilles på forskellige måder ved hjælp af svovl fra forskellige kilder. Den mest almindelige metode involverer kontaktprocessen for produktion af svovlsyre.
Sidste artikelEr vandkemisk forvitring fysisk eller begge dele?
Næste artikelHalidesoxider og sulfater er eksempler på hvad mineraler?
 Varme artikler
Varme artikler
-
 Opblæsning af middelalderlige krudtopskrifterForskere testede middelalderlige krudtopskrifter i denne kopi af en stenkastende kanon fra det tidlige 15. århundrede. Kredit:Tilpasset fra ACS Omega 2021 Først brugt til kamp i Kina omkring 900 e
Opblæsning af middelalderlige krudtopskrifterForskere testede middelalderlige krudtopskrifter i denne kopi af en stenkastende kanon fra det tidlige 15. århundrede. Kredit:Tilpasset fra ACS Omega 2021 Først brugt til kamp i Kina omkring 900 e -
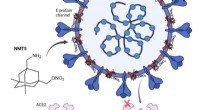 Nyt lægemiddel har potentiale til at vende SARS-CoV-2-virus mod sig selvEt lægemiddel udviklet af Scripps Research-forskere forhindrer SARS-CoV-2 (blå) i at binde sig til ACE2-receptorer (lyserøde) for at inficere menneskelige celler. Lægemidlet hæfter sig på virussen og
Nyt lægemiddel har potentiale til at vende SARS-CoV-2-virus mod sig selvEt lægemiddel udviklet af Scripps Research-forskere forhindrer SARS-CoV-2 (blå) i at binde sig til ACE2-receptorer (lyserøde) for at inficere menneskelige celler. Lægemidlet hæfter sig på virussen og -
 Ny tilgang forbedrer evnen til at forudsige metals reaktioner med vandVanddråbe. Billede:Wikimedia Commons Den brede rækkevidde af korrosion, et globalt problem på flere milliarder dollars, kan en dag blive indsnævret betydeligt takket være en ny, bedre tilgang til
Ny tilgang forbedrer evnen til at forudsige metals reaktioner med vandVanddråbe. Billede:Wikimedia Commons Den brede rækkevidde af korrosion, et globalt problem på flere milliarder dollars, kan en dag blive indsnævret betydeligt takket være en ny, bedre tilgang til -
 Springende firben:Forskning tester grænserne for gekko-adhæsionEn tokay gekko, der klamrer sig til en glat overflade. Kredit:William Stewart Mange gekkoer bor i træer, bor ofte højt i baldakinen. Stoler på deres utrolige klæbestyrke for at hjælpe dem med at b
Springende firben:Forskning tester grænserne for gekko-adhæsionEn tokay gekko, der klamrer sig til en glat overflade. Kredit:William Stewart Mange gekkoer bor i træer, bor ofte højt i baldakinen. Stoler på deres utrolige klæbestyrke for at hjælpe dem med at b
- Hvad er de forskellige energikilder, der plejede at levere dit samfund?
- De Beers til at sælge syntetiske diamanter - her er, hvordan de er lavet
- Irmas kraftig nedbør målt af NASAs IMERG
- Hvor kommer elektroner til fotosystem II fra?
- Hvorfor Bitcoins grundlægger betyder noget, da spotlight rammer australske
- Datering af det gamle minoiske udbrud af Thera ved hjælp af træringe


