Hvordan kan du forklare krystallisering ved hjælp af partikelteorien?
Partikelteori Grundlæggende:
* Materiale er lavet af små partikler: Disse partikler bevæger sig konstant og vibrerer.
* Arrangementet og bevægelsen af partikler bestemmer stoftilstanden: Faststoffer har tæt pakket partikler, der vibrerer i faste positioner, mens væsker har mere plads mellem partikler og kan bevæge sig rundt, og gasser har mest plads og bevæger sig frit.
Krystallisationsproces:
1. opløste: Når et stof opløses, adskilles partiklerne fra hinanden og bliver omgivet af opløsningsmiddeltpartikler. I tilfælde af krystallisation opløses stoffet normalt i en væske.
2. afkøling eller fordampning: Når opløsningen afkøles, eller opløsningsmidlet fordamper, har partiklerne mindre energi og bevæger sig langsommere.
3. nucleation: De opløste partikler begynder at kollidere og klæber sammen og danner små klynger kaldet "kerner." Disse kerner fungerer som udgangspunkt for krystalvækst.
4. vækst: Flere partikler kolliderer med kernerne og fastgør sig, hvilket får krystallerne til at vokse større. Partiklerne arrangerer sig i et meget ordnet, gentagende mønster, som er det definerende egenskab ved en krystal.
5. krystalform: Den specifikke form af krystallen bestemmes af arrangementet af partiklerne i krystalgitteret. De stærke bindinger mellem partiklerne skaber specifikke vinkler og ansigter.
Partikelteori Forklaring:
* afkøling eller fordampning reducerer partiklernes energi: Dette får dem til at bevæge sig langsommere og øger chancen for kollisioner og tilknytning.
* tiltrækningen mellem partikler: I en krystal har partikler en stærk attraktion for hinanden, hvilket får dem til at klæbe sammen i specifikke og gentagne mønstre. Denne attraktion er stærkere end kræfterne mellem partiklerne og opløsningsmidlet.
* Bestilt arrangement: Når krystallen vokser, arrangerer partiklerne sig i et regelmæssigt, gentagende mønster. Dette mønster dikteres af kræfterne til tiltrækning mellem partiklerne.
Eksempel:
Forestil dig salt, der opløses i vand. Saltpartiklerne er omgivet af vandmolekyler og holder dem adskilt. Når vandet fordamper, mister saltpartiklerne deres energi og begynder at kollidere. Deres stærke tiltrækning til hinanden får dem til at klæbe sammen og danne små saltkrystaller. Disse krystaller vokser, når flere saltpartikler binder sig i et specifikt arrangement.
Sammenfattende er krystallisation en proces, hvor partikler i en løsning samles, mister energi og arrangerer sig selv i et ordnet, gentagne mønster på grund af den stærke tiltrækning mellem dem.
Sidste artikelHvilket mineral vil ridse fluorit galena og pyroxen?
Næste artikelHvilke elementer er i C10H16O3N2S?
 Varme artikler
Varme artikler
-
 Video:Coronavirus-vaccine:Hvor er vi, og hvad er det næste?Kredit:The American Chemical Society Du har måske hørt, at COVID-19-vaccineforsøg er i gang i Seattle. Hvad er det præcist, der testes? Hvor meget længere vil disse test tage? Og hvornår kan vi f
Video:Coronavirus-vaccine:Hvor er vi, og hvad er det næste?Kredit:The American Chemical Society Du har måske hørt, at COVID-19-vaccineforsøg er i gang i Seattle. Hvad er det præcist, der testes? Hvor meget længere vil disse test tage? Og hvornår kan vi f -
 Lær livet et nyt trick:Bakterier danner bor-kulstofbindingerKunstnerens fortolkning af en videnskabsmand, der introducerer bor til livets kulstofbaserede kemi. Jennifer Kan, Xiongyi Huang og deres team fra Caltech-laboratoriet hos Frances Arnold har skabt bakt
Lær livet et nyt trick:Bakterier danner bor-kulstofbindingerKunstnerens fortolkning af en videnskabsmand, der introducerer bor til livets kulstofbaserede kemi. Jennifer Kan, Xiongyi Huang og deres team fra Caltech-laboratoriet hos Frances Arnold har skabt bakt -
 Forskere udvikler billige, energieffektive materialerAndrey Bazlov, en af forfatterne til undersøgelsen, en ingeniør hos NUST MISIS. Kredit:NUST MISIS Et internationalt team af forskere fra National University of Science and Technology MISIS (NUST
Forskere udvikler billige, energieffektive materialerAndrey Bazlov, en af forfatterne til undersøgelsen, en ingeniør hos NUST MISIS. Kredit:NUST MISIS Et internationalt team af forskere fra National University of Science and Technology MISIS (NUST -
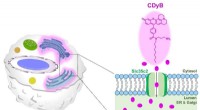 En enklere måde at differentiere B-celler og T-celler påDen foreslåede farvningsmekanisme af CDyB. Kredit:Institut for Grundvidenskab Vores immunsystem er afgørende for vores overlevelse, da vores kroppe konstant bliver udsat for bakterier, vira, parasi
En enklere måde at differentiere B-celler og T-celler påDen foreslåede farvningsmekanisme af CDyB. Kredit:Institut for Grundvidenskab Vores immunsystem er afgørende for vores overlevelse, da vores kroppe konstant bliver udsat for bakterier, vira, parasi
- Hvad er forårsaget af den lige tilpasning af Sun Earth og Moon?
- Syngenta afgør amerikanske landmandssager i en sag om handel med majs i Kina
- Oprensning af Shanghai-floden efterlader bådbeboere i limbo
- Opfyldelse af mål for bæredygtig udvikling kræver mere samarbejde mellem discipliner
- Facebook, YouTube:Virksomheden skal stoppe med at skrabe ansigter fra websteder
- Hvad forurener luften?


