Er jodhexafluorid en ionisk eller molekylær forbindelse?
* Elektronegativitetsforskel: Fluor er det mest elektronegative element, og jod har en signifikant lavere elektronegativitet. Selvom der er forskel i elektronegativitet, er den ikke stor nok til at danne en fuldt ionisk binding. Forskellen i elektronegativitet resulterer i en polær kovalent binding.
* molekylær struktur: IF₆ har en octahedral molekylær geometri med jodatom i midten og seks fluoratomer, der omgiver det. Denne struktur antyder et kovalent bindingsmønster, hvor atomerne deler elektroner i stedet for fuldt ud at overføre dem.
* Fysiske egenskaber: Molekylære forbindelser har generelt lavere smelte- og kogepunkter sammenlignet med ioniske forbindelser. Jodhexafluorid er en væske ved stuetemperatur, der er på linje med egenskaberne ved molekylære forbindelser.
Kortfattet , mens der er en vis polaritet inden for IF₆ -molekylet på grund af elektronegativitetsforskellen mellem jod og fluor, er den samlede binding kovalent, hvilket gør det til en molekylær forbindelse.
Sidste artikelHvor mange atomer er der i et molekyle af CCL4?
Næste artikelFem ting, der er lavet af krystaller?
 Varme artikler
Varme artikler
-
 Opdager den næste generation af katalysatorerProfessor Jan Rossmeisl Ved hjælp af to ph.d. -studerende Jack K. Pedersen og Thomas A.A. Batchelor. Kredit:Københavns Universitet Brugen af solenergi og vindenergi skal fordobles for at imødeko
Opdager den næste generation af katalysatorerProfessor Jan Rossmeisl Ved hjælp af to ph.d. -studerende Jack K. Pedersen og Thomas A.A. Batchelor. Kredit:Københavns Universitet Brugen af solenergi og vindenergi skal fordobles for at imødeko -
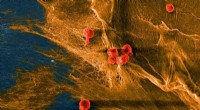 Blødt, men sejt:Biohybridmateriale fungerer som bruskMikrografi af et biohybrid kompositmateriale udviklet hos Cornell viser celler (røde) udsået på de fibrøse domæner (gule) af kollagen. Materialet efterligner naturligt væv i dets blødhed, sejhed og ev
Blødt, men sejt:Biohybridmateriale fungerer som bruskMikrografi af et biohybrid kompositmateriale udviklet hos Cornell viser celler (røde) udsået på de fibrøse domæner (gule) af kollagen. Materialet efterligner naturligt væv i dets blødhed, sejhed og ev -
 Composite metal foam overgår aluminium til brug i flyvingerKredit:CC0 Public Domain De forreste kanter på flyvinger skal opfylde et meget krævende sæt egenskaber. Ny forskning viser, at en kombination af stålkompositmetalskum (CMF) og epoxyharpiks har mer
Composite metal foam overgår aluminium til brug i flyvingerKredit:CC0 Public Domain De forreste kanter på flyvinger skal opfylde et meget krævende sæt egenskaber. Ny forskning viser, at en kombination af stålkompositmetalskum (CMF) og epoxyharpiks har mer -
 Kulstofopsamlingsteknologi skrubber CO2 fra kraftværker som dykkerudstyrCO2 frigives ved mild opvarmning af det faste BIG-bicarbonat. Den frigivne CO2-gas er fanget i den orange ballon, mens de frigjorte vanddampe fanges af kondens i det isafkølede U-formede rør. Kredit:N
Kulstofopsamlingsteknologi skrubber CO2 fra kraftværker som dykkerudstyrCO2 frigives ved mild opvarmning af det faste BIG-bicarbonat. Den frigivne CO2-gas er fanget i den orange ballon, mens de frigjorte vanddampe fanges af kondens i det isafkølede U-formede rør. Kredit:N
- Er gifte mennesker gladere end singler?
- Opdagelse af, hvordan koralrev tilpasser sig den globale opvarmning, kan hjælpe med at genoprette r…
- Hvad er den kontrollerede variabel i eksperimentet på spontan generation?
- Sådan beregnes gennemsnitsfrekvens
- Hvad er højrehåndsreglen for vinkelforskydning?
- Hvorfor det kunne gavne bjørne og fiskere at lade laksen slippe ud


