Er en reaktiv væske, den udfører ikke elektricitet med valens 1 i sin forbindelse?
* reaktiv væske: Dette fortæller os, at stoffet er kemisk aktivt, hvilket betyder, at det let deltager i kemiske reaktioner.
* udfører ikke elektricitet: Dette indikerer, at stoffet er en ikke-elektrolyt. Ikke-elektrolytter har ikke frit bevægende ioner (ladede partikler) i opløsning, som er nødvendige for elektrisk ledningsevne.
* Valency 1 i sin forbindelse: Valency henviser til et elements kombinationskapacitet. En valens på 1 betyder, at et element kan danne en kemisk binding.
Her er problemet:
* Ikke-elektrolytter danner generelt ikke ioniske forbindelser. Ioniske forbindelser holdes sammen af den elektrostatiske tiltrækning mellem positivt og negativt ladede ioner. Disse ioner er det, der giver mulighed for elektrisk ledningsevne i opløsning.
* Valency 1 angiver normalt, at et element danner ioniske bindinger. Elementer med en valens på 1 taber eller får en elektron typisk for at opnå en stabil elektronkonfiguration, der danner en ion med en +1 eller -1 ladning.
Eksempler:
* natrium (NA) har en valens på 1 og danner Na+ -ioner. Natriumchlorid (NaCl) er en klassisk ionisk forbindelse, der udfører elektricitet, når den opløses i vand.
* klor (CL) har også en valens på 1 og danner kløer. Igen fører dette til ionisk sammensat dannelse.
Konklusion:
Det er meget usandsynligt, at en reaktiv væske, der ikke udfører elektricitet, ville have en valens på 1 i dens forbindelse. Denne kombination er i modstrid med den typiske opførsel af elementer med valency 1.
Mulige undtagelser:
Der kan være nogle meget specifikke og sjældne undtagelser, der involverer meget kovalente forbindelser med usædvanlige egenskaber. Disse ville dog ikke være den generelle regel.
Sidste artikelHvilket element har karakteristika, der mest ligner fluor?
Næste artikelHvad er forbindelserne i Na Cl?
 Varme artikler
Varme artikler
-
 Rapid DNA identificerer ofre for undfangelsesbådbrandKredit:U.S. Department of Homeland Security 34 mennesker døde i en tragisk bådbrand den 2. september. 2019, ud for Santa Cruz Islands kyst, Californien. Fem besætningsmedlemmer slap med skader eft
Rapid DNA identificerer ofre for undfangelsesbådbrandKredit:U.S. Department of Homeland Security 34 mennesker døde i en tragisk bådbrand den 2. september. 2019, ud for Santa Cruz Islands kyst, Californien. Fem besætningsmedlemmer slap med skader eft -
 Ingeniører skaber smart aerogel, der gør luft til drikkevandDen vandproducerende aerogel er opfundet af et team på seks forskere under ledelse af professor Ho Ghim Wei (til venstre). To af dem er Dr. Gamze Yilmaz (i midten) og Dr. Fan Lu Meng (til højre). Kred
Ingeniører skaber smart aerogel, der gør luft til drikkevandDen vandproducerende aerogel er opfundet af et team på seks forskere under ledelse af professor Ho Ghim Wei (til venstre). To af dem er Dr. Gamze Yilmaz (i midten) og Dr. Fan Lu Meng (til højre). Kred -
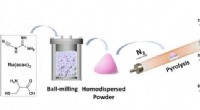 Nye enkelt-atom katalyse støvler reduktiv amineringsreaktionSkematisk illustration til fremstilling af Ru1/NC-T katalysatorer. Kredit:DICP Den geometriske isolering af metalarter i single-atom catalyse (SACer) maksimerer ikke kun atomudnyttelseseffektivite
Nye enkelt-atom katalyse støvler reduktiv amineringsreaktionSkematisk illustration til fremstilling af Ru1/NC-T katalysatorer. Kredit:DICP Den geometriske isolering af metalarter i single-atom catalyse (SACer) maksimerer ikke kun atomudnyttelseseffektivite -
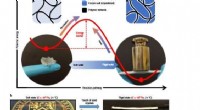 Et hybridmateriale, der skifter reversibelt mellem to stabile faste tilstande58 ° C). (c) Ved højt polymerindhold (P30L10), materialet er elastisk og fleksibelt, deformeres ved vridning, men vender tilbage til den oprindelige faste form, når kraften frigives. Ved lavt polymeri
Et hybridmateriale, der skifter reversibelt mellem to stabile faste tilstande58 ° C). (c) Ved højt polymerindhold (P30L10), materialet er elastisk og fleksibelt, deformeres ved vridning, men vender tilbage til den oprindelige faste form, når kraften frigives. Ved lavt polymeri
- Walmart ansætter 150, 000 arbejdere, da virus spredes i USA
- At bryde temperaturbarrieren ved afprøvning af materialer i lille skala
- Hvilken stiv zone på overfladen danner drivende tektoniske plader?
- Er naturen maskulin eller feminin på fransk?
- At lave mere MXene:Forskere løfter sløret for et skalerbart produktionssystem til de lovende, 2-D …
- Hvad hvis homeostase mislykkes?


