Hvorfor består saltvand af positive og negative ioner?
1. Salt (NaCl) er en ionisk forbindelse:
* Salt består af natrium (NA) og klor (CL) atomer.
* Natrium har en elektron i sin yderste skal, som det let mister for at blive en positivt ladet ion (Na+).
* Klor har syv elektroner i sin yderste skal og får let en elektron til at blive en negativt ladet ion (Cl-).
* Disse modsatte ladede ioner holdes sammen af elektrostatiske kræfter og danner en ionisk binding.
2. Vand (H2O) er et polært molekyle:
* Vandmolekyler har en bøjet form, hvor iltatomet er lidt negativt, og brintatomerne er lidt positive.
* Denne polaritet tillader vandmolekyler at interagere med ioner gennem elektrostatiske interaktioner.
3. Opløsning af salt i vand:
* Når salt tilsættes til vand, omgiver de polære vandmolekyler Na+ og Cl- ionerne.
* Den negative ilt ende af vandmolekyler tiltrækker de positive Na+ -ioner.
* Den positive brint ende af vandmolekyler tiltrækker de negative kloder.
* Denne proces svækker den ioniske binding, der holder saltet sammen, hvilket får ionerne til at adskille sig og blive omgivet af vandmolekyler.
4. Resultat:En løsning af ioner
* De separerede Na+ og Cl- ioner bliver omgivet af vandmolekyler, der effektivt opløses i vandet.
* Denne proces skaber en opløsning, hvor vandmolekylerne nu er omgivet af både positive (Na+) og negative (Cl-) ioner, hvilket giver saltvand sin karakteristiske ioniske natur.
Kortfattet: Den polære karakter af vandmolekyler giver dem mulighed for at interagere med de modsatte ladede ioner i salt, bryde den ioniske binding og skabe en opløsning med fritflydende positive og negative ioner.
Sidste artikelMolforhold mellem sølv og kobber?
Næste artikelHvilken type bindingsformer mellem cæsium og jod?
 Varme artikler
Varme artikler
-
 Tilføj bare nanomaterialer for stærkere, hårdere dykkerfinnerSpecialist i undervandsudstyr Alchemy gik sammen med Adamant Composites om at anvende nanomaterialer for at producere stærkere, hårdere kompositmateriale til dykkerfinner. Kredit:Alkymi Tilføjelse
Tilføj bare nanomaterialer for stærkere, hårdere dykkerfinnerSpecialist i undervandsudstyr Alchemy gik sammen med Adamant Composites om at anvende nanomaterialer for at producere stærkere, hårdere kompositmateriale til dykkerfinner. Kredit:Alkymi Tilføjelse -
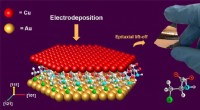 Forskere bruger aminosyrer til at dyrke højtydende kobber tynde filmKobbertynde film fremstilles ved elektroaflejring af kobber, Cu (111), på et selvsamlet organisk monolag af aminosyren L-cystein på guld, Au (111). Kredit:Bin Luo For første gang, forskere fra Mis
Forskere bruger aminosyrer til at dyrke højtydende kobber tynde filmKobbertynde film fremstilles ved elektroaflejring af kobber, Cu (111), på et selvsamlet organisk monolag af aminosyren L-cystein på guld, Au (111). Kredit:Bin Luo For første gang, forskere fra Mis -
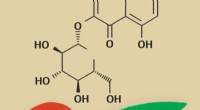 Biokemikere forbinder polyfenoler i ferskenblade med deres ekstrakts antioxidanteffektKredit:RUDN Universitet Biokemikere fra RUDN University har fastslået, hvilke stoffer i ferskenblade, der giver den antioxidante virkning af deres ekstrakt. De undersøgte sammensætningen af pulv
Biokemikere forbinder polyfenoler i ferskenblade med deres ekstrakts antioxidanteffektKredit:RUDN Universitet Biokemikere fra RUDN University har fastslået, hvilke stoffer i ferskenblade, der giver den antioxidante virkning af deres ekstrakt. De undersøgte sammensætningen af pulv -
 Brudsejhed af materialet til flykonstruktion øges med 1,5 gangeKredit:Pixabay/CC0 Public Domain Forskere fra NUST MISIS har fundet en måde at øge brudsejheden af siliciumcarbid, et lovende konstruktionsmateriale til fremstilling af ildfaste dele, 1,5 gange.
Brudsejhed af materialet til flykonstruktion øges med 1,5 gangeKredit:Pixabay/CC0 Public Domain Forskere fra NUST MISIS har fundet en måde at øge brudsejheden af siliciumcarbid, et lovende konstruktionsmateriale til fremstilling af ildfaste dele, 1,5 gange.
- Italien, Kina foreslår en løsning på Tchads-søens vandproblem
- Metabolisk manipuleret bakterie producerer lutein
- Hvilken rolle spiller atmosfæren i energiflow fra sol til jorden?
- Hvad er de otte niveauer af organisering fra mindste til største organismersorganismersystemer atom…
- Terningkast:Kvantemekanikforskere viser, at naturen er uforudsigelig
- Fødevareforskere skaber nye magnetiske nanopartikler til hurtig screening af pesticidrester i grøn…


