Hvordan kan jeg se, om en kemisk reaktion er afbalanceret eller ikke afbalanceret?
forståelse af det grundlæggende
* Kemiske ligninger: Kemiske reaktioner er repræsenteret ved kemiske ligninger. Disse ligninger viser reaktanterne (udgangsmaterialer) på venstre side og de produkter (stoffer dannet) på højre side, adskilt af en pil.
* bevarelse af masse: Det grundlæggende princip bag afbalancering af kemiske ligninger er loven om bevarelse af masse. Denne lov hedder det, at der ikke kan oprettes eller ødelægges i almindelige kemiske reaktioner. Derfor skal den samlede masse af reaktanterne svare til den samlede masse af produkterne.
trin til at afbalancere en kemisk ligning
1. Skriv den ubalancerede ligning: Start med at skrive de kemiske formler for reaktanter og produkter. For eksempel:
`` `
H2 + O2 → H2O
`` `
2. tællingsatomer: Tæl forsigtigt antallet af atomer i hvert element på begge sider af ligningen.
* reaktanter:
* H:2 atomer
* O:2 atomer
* Produkter:
* H:2 atomer
* O:1 atom
3. Juster koefficienter: For at afbalancere ligningen skal du justere koefficienterne (tal foran de kemiske formler). Koefficienter multiplicerer hele formlen og ændrer antallet af atomer.
* I vores eksempel har vi brug for mere ilt på produktsiden. Lad os prøve dette:
`` `
H2 + O2 → 2H2O
`` `
4. Fortæl atomer: Efter justering af koefficienterne, tæl atomerne igen:
* reaktanter:
* H:2 atomer
* O:2 atomer
* Produkter:
* H:4 atomer
* O:2 atomer
5. balance yderligere (hvis nødvendigt): Nu er ilt afbalanceret, men brint er det ikke. Vi har brug for mere brint på reaktantsiden:
`` `
2H2 + O2 → 2H2O
`` `
6. Endelig check: Tæl atomerne en sidste gang. Den afbalancerede ligning skal have det samme antal af hver type atom på begge sider.
* reaktanter:
* H:4 atomer
* O:2 atomer
* Produkter:
* H:4 atomer
* O:2 atomer
Vigtige noter:
* ændrer kun koefficienter: Skift aldrig underskrifterne i de kemiske formler. Ændring af underskrifter ændrer den faktiske kemiske forbindelse.
* fraktioner er tilladt: Du kan bruge fraktioner som koefficienter under afbalanceringsprocessen. Det er dog normalt bedst at multiplicere alt med nævneren for at få hele tal i den endelige ligning.
* praksis, praksis, praksis: Afbalanceringsligninger tager praksis. Bliv ikke modløs, hvis det virker vanskeligt i starten.
Fortæl mig, hvis du gerne vil have mig til at afbalancere en specifik kemisk ligning!
 Varme artikler
Varme artikler
-
 Ny metode kunne hjælpe med at producere renere, sikrere stofferOptisk aktivitet af molekyler forstærkes i mere end 10 gange, ved strukturspecifik adsorption af molekylerne på chirale nanopartikler. Kredit:HKBU Fysik- og kemiforskere fra Hong Kong Baptist Univ
Ny metode kunne hjælpe med at producere renere, sikrere stofferOptisk aktivitet af molekyler forstærkes i mere end 10 gange, ved strukturspecifik adsorption af molekylerne på chirale nanopartikler. Kredit:HKBU Fysik- og kemiforskere fra Hong Kong Baptist Univ -
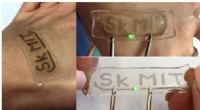 Team udvikler enkel hydrogelmodifikationsmetode mod strækbar og gennemsigtig elektronikSWCNT/hydrogel-baseret mønstret kredsløb afbildet på tre måder:knyttet til menneskelig hud, afslappet, og strakt med 50 pct. Kredit:Skoltech Forskere fra Skolkovo Institute of Science and Technolo
Team udvikler enkel hydrogelmodifikationsmetode mod strækbar og gennemsigtig elektronikSWCNT/hydrogel-baseret mønstret kredsløb afbildet på tre måder:knyttet til menneskelig hud, afslappet, og strakt med 50 pct. Kredit:Skoltech Forskere fra Skolkovo Institute of Science and Technolo -
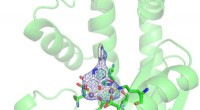 Fremskridt mod en ny influenzabehandling, takket være en lille justeringEt nyt antiviralt lægemiddel hæmmer replikation af influenzas genom ved at binde sig til manganioner (lilla kugler). Kredit:Christine Morrison Dette års uventet aggressive influenzasæson minder al
Fremskridt mod en ny influenzabehandling, takket være en lille justeringEt nyt antiviralt lægemiddel hæmmer replikation af influenzas genom ved at binde sig til manganioner (lilla kugler). Kredit:Christine Morrison Dette års uventet aggressive influenzasæson minder al -
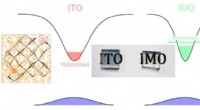 Forskere design opdagelse fordobler ledningsevnen af indiumoxid gennemsigtige belægningerOverlegne transparente ledende egenskaber af indiumoxid realiseret af molybdændonorer, der resonanserer i ledningsbåndet, undgå skadelige virkninger af tin-doping. Kredit:University of Liverpool F
Forskere design opdagelse fordobler ledningsevnen af indiumoxid gennemsigtige belægningerOverlegne transparente ledende egenskaber af indiumoxid realiseret af molybdændonorer, der resonanserer i ledningsbåndet, undgå skadelige virkninger af tin-doping. Kredit:University of Liverpool F
- Under vulkanske udbrud er disse solarrangementer spektakulære?
- Ultrakorte peptider går langt for vævsteknologi
- Hvordan man designer sikre og bæredygtige kemikalier
- International Astronomical Union er enige om en ny referenceramme for retninger i rummet
- Hvad simulerer tapning af DNA på stort papir?
- Hvad er det største og højeste vulkanske bjerg i universet?


