Reagerer natrium med andre elementer?
* Meget elektropositiv: Natrium har en enkelt elektron i sin ydre skal, som det let mister for at opnå en stabil elektronkonfiguration. Dette gør det meget elektropositivt, hvilket betyder, at det har en stærk tendens til at miste elektroner og danne positive ioner (Na+).
* lav ioniseringsenergi: Det kræver relativt lidt energi at fjerne det enkelte ydre elektron fra et natriumatom.
Her er nogle eksempler på Natriums reaktivitet:
* reaktion med vand: Natrium reagerer voldsomt med vand og producerer brintgas (som er brandfarlig) og natriumhydroxid (en stærk alkali).
* 2NA (S) + 2H2O (L) → 2NAOH (AQ) + H2 (G)
* reaktion med halogener: Natrium reagerer kraftigt med halogener (som klor, brom og iod) for at danne ioniske salte.
* 2NA (S) + CL2 (G) → 2NACL (S)
* reaktion med ilt: Natrium reagerer med ilt i luften for at danne natriumoxid (Na2O). I nærvær af fugt kan dette yderligere reagere på dannelsen af natriumhydroxid.
* 4NA (S) + O2 (G) → 2NA2O (S)
* reaktion med syrer: Natrium reagerer med syrer for at producere brintgas og det tilsvarende salt.
* 2NA (S) + 2HCI (AQ) → 2NACl (AQ) + H2 (G)
* reaktion med ikke-metaler: Natrium reagerer med mange andre ikke-metaller, danner ioniske forbindelser.
Vigtig sikkerhed Bemærk: Natrium er et meget reaktivt element og bør håndteres med ekstrem omhu. Det er bedst at undgå kontakt med det og altid arbejde med natrium i et godt ventileret område under opsyn af en kvalificeret professionel.
 Varme artikler
Varme artikler
-
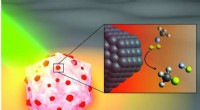 Team afslører katalysator, der kan bryde problematiske C-F-bindingerEn kunstners illustration af den lysaktiverede antenne-reaktor-katalysator Rice University-ingeniører designet til at bryde kulstof-fluor-bindinger i fluorcarboner. Aluminiumsdelen af partiklen (hvi
Team afslører katalysator, der kan bryde problematiske C-F-bindingerEn kunstners illustration af den lysaktiverede antenne-reaktor-katalysator Rice University-ingeniører designet til at bryde kulstof-fluor-bindinger i fluorcarboner. Aluminiumsdelen af partiklen (hvi -
 Hvorfor ananasblade er en lovende kandidat til at erstatte plastmaterialer, der bruges i engangsmask…Kredit:CC0 Public Domain COVID-19-pandemien har ført til en øget efterspørgsel efter engangsmasker, hvilket lægger pres på globale problemer med plastikaffald. En enkelt ansigtsmaske kan frigive s
Hvorfor ananasblade er en lovende kandidat til at erstatte plastmaterialer, der bruges i engangsmask…Kredit:CC0 Public Domain COVID-19-pandemien har ført til en øget efterspørgsel efter engangsmasker, hvilket lægger pres på globale problemer med plastikaffald. En enkelt ansigtsmaske kan frigive s -
 Stærke kunstige kulfibermuskler kan løfte 12, 600 gange deres egen vægtZoom ind på den kulfiberforstærkede oprullede muskel med en diameter på 0,4 mm. Kredit:University of Illinois Department of Mechanical Science and Engineering Optrækket, en øvelse frygtet af de fl
Stærke kunstige kulfibermuskler kan løfte 12, 600 gange deres egen vægtZoom ind på den kulfiberforstærkede oprullede muskel med en diameter på 0,4 mm. Kredit:University of Illinois Department of Mechanical Science and Engineering Optrækket, en øvelse frygtet af de fl -
 Forskere opdager en ny vej til dannelse af komplekse krystallerForskere brugte avancerede mikroskopiteknikker til at se mesokrystaller dannes i realtid. Kredit:Sammensat billede af Mike Perkins | Pacific Northwest National Laboratory Når materialer når ekstre
Forskere opdager en ny vej til dannelse af komplekse krystallerForskere brugte avancerede mikroskopiteknikker til at se mesokrystaller dannes i realtid. Kredit:Sammensat billede af Mike Perkins | Pacific Northwest National Laboratory Når materialer når ekstre
- Hvordan bruger du spektrale linjer til at bestemme, om en galakse bevæger sig mod Jorden eller væk…
- Kan din krop leve på 80 grader Fahrenheit?
- Hvilken kirtel producerer seratonin?
- Angiv en observerbar karakteristisk anden end krystalstørrelse, der gør granit forskellig fra basa…
- Hvilken gas lægger de i en pose med chips for at forhindre den i at blive klemt?
- Forskere skaber selvsamlede logiske kredsløb fra proteiner


