Hvad er virkningen af NaCl og CaCl2 på kogepunktvand?
Her er hvorfor:
* Kolligative egenskaber: Disse egenskaber ved en opløsning afhænger udelukkende af antallet af tilstedeværende opløste partikler, ikke deres specifikke identitet.
* kogepunkthøjde: Når et opløst stof (som NaCl eller CaCl₂) opløses i et opløsningsmiddel (som vand), forstyrrer det opløsningsmidlets damptryk. For at nå kogepunktet (hvor damptrykket er lig med atmosfæretrykket), skal opløsningen opvarmes til en højere temperatur end rent vand.
Vigtig note:
* dissociation: NaCl og CaCl₂ dissocieres i ioner i vand. NaCl danner to ioner (Na⁺ og Cl⁻), mens CACL₂ danner tre ioner (Ca²⁺ og 2Cl⁻). Jo flere ioner produceret, jo større er virkningen på kogepunkthøjde.
* molalitet: Omfanget af kogepunkthøjde er direkte proportional med molaliteten af opløsningen (mol opløst stof pr. Kg opløsningsmiddel). En mere koncentreret opløsning vil have et højere kogepunkt.
Kortfattet:
Tilføjelse af NaCl eller CaCl₂ til vand hæver sit kogepunkt. Effekten er større med CaCl₂ på grund af dets højere antal ioner efter dissociation. Størrelsen af effekten afhænger af koncentrationen af opløsningen.
Sidste artikelEr luft forseglet i en krukke gas?
Næste artikelHvordan kan calcium og fosfat gøre en forbindelse med elektronutralitet?
 Varme artikler
Varme artikler
-
 Lavpris gelfilm kan plukke drikkevand fra ørkenluftenEn prototype enhed til at opfange vand fra luften ved hjælp af den nye film. Kredit:University of Texas i Austin Mere end en tredjedel af verdens befolkning bor i tørre områder, områder med betydel
Lavpris gelfilm kan plukke drikkevand fra ørkenluftenEn prototype enhed til at opfange vand fra luften ved hjælp af den nye film. Kredit:University of Texas i Austin Mere end en tredjedel af verdens befolkning bor i tørre områder, områder med betydel -
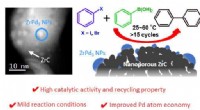 En kombineret strategi i katalysatordesign til Suzuki krydskoblingerOversigt over den nye Pd-ZrC heterogene katalysator. Den nye katalysator består af ZrPd3-nanopartikler dyrket på en inert ZrC-understøtning. Dens enkle fremstillingsprocedure, kombineret med dets mang
En kombineret strategi i katalysatordesign til Suzuki krydskoblingerOversigt over den nye Pd-ZrC heterogene katalysator. Den nye katalysator består af ZrPd3-nanopartikler dyrket på en inert ZrC-understøtning. Dens enkle fremstillingsprocedure, kombineret med dets mang -
 Meget selektive fotokatalysatorer til ikke-oxidativ kobling af metanSkematisk illustration for konstrueret Pdn /TiO2 . Kredit:Zhang Wenqing et al. Metan (CH4 ) er hovedbestanddelen af flydende naturgas. Men forbrændingen af metan genererer en kritisk mængde kul
Meget selektive fotokatalysatorer til ikke-oxidativ kobling af metanSkematisk illustration for konstrueret Pdn /TiO2 . Kredit:Zhang Wenqing et al. Metan (CH4 ) er hovedbestanddelen af flydende naturgas. Men forbrændingen af metan genererer en kritisk mængde kul -
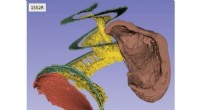 Enestående 3D-billeder af menneskets øres anatomi til genoprettelse af hørelsenBillede af det indre øre. Kredit:Canadian Light Source Ved at bruge avancerede teknikker ved den canadiske lyskilde (CLS) ved University of Saskatchewan, forskere har skabt tredimensionelle billed
Enestående 3D-billeder af menneskets øres anatomi til genoprettelse af hørelsenBillede af det indre øre. Kredit:Canadian Light Source Ved at bruge avancerede teknikker ved den canadiske lyskilde (CLS) ved University of Saskatchewan, forskere har skabt tredimensionelle billed
- Nyt værktøj hjælper videnskabsmænd med bedre at målrette søgen efter fremmed liv
- Hvilke hoveddele har alle bakterieceller?
- Kosmologer foreslår en ny måde at danne primordiale sorte huller på
- Hubble opdager en farlig galaktisk dans
- Videospildesigner etablerer laboratorium for vedvarende energi
- Hvorfor er den kemiske sammensætning af et mineral vigtig?


