Hvad er reaktiviteten af lithium?
* lav ioniseringsenergi: Lithium har den laveste ioniseringsenergi for alle alkalimetaller, hvilket betyder, at den let mister sin yderste elektron til at danne en +1 -kation. Dette gør det meget reaktivt.
* lille atomstørrelse: Lithium har den mindste atomradius blandt alkalimetaller. Dette betyder, at dens valenselektron holdes mindre tæt af kernen og er lettere tilgængelig for kemiske reaktioner.
* Elektropositiv karakter: Lithium er meget elektropositiv, hvilket betyder, at det har en stærk tendens til at miste elektroner og blive en positiv ion.
Reaktivitetsmanifestationer:
* reaktion med vand: Lithium reagerer kraftigt med vand og producerer brintgas og lithiumhydroxid. Reaktionen er eksoterm og kan endda antænde brintet.
* reaktion med luft: Lithium reagerer let med ilt i luften for at danne lithiumoxid. Det reagerer også med nitrogen for at danne lithiumnitrid.
* reaktion med halogener: Lithium reagerer kraftigt med halogener (fluor, klor, brom, jod) for at danne lithiumhalogenider.
* reaktion med syrer: Lithium reagerer voldsomt med syrer og producerer brintgas og lithiumsalte.
Sikkerhedshensyn:
På grund af sin høje reaktivitet er lithium et farligt stof at håndtere. Det skal opbevares i en tør, inert atmosfære for at forhindre kontakt med luft og fugt.
Ansøgninger:
På trods af sin reaktivitet har Lithium flere vigtige anvendelser, herunder:
* Batterier: Lithium-ion-batterier er vidt brugt i bærbar elektronik, elektriske køretøjer og energilagringssystemer.
* medicinske anvendelser: Lithiumcarbonat bruges til behandling af bipolar lidelse.
* smøremidler: Lithiumfedt bruges som et smøremiddel i forskellige anvendelser.
Kortfattet: Lithiums høje reaktivitet stammer fra dens lave ioniseringsenergi, lille atomstørrelse og elektropositiv karakter. Dette gør det til et kraftfuldt reduktionsmiddel og en værdifuld komponent i forskellige teknologier.
 Varme artikler
Varme artikler
-
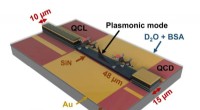 Miniaturiseret lab-on-a-chip til kemisk analyse af væsker i realtidOn-chip sensorkoncept inklusive angivet plasmonisk tilstand. Emitter (QCL, 10 μm bred) og detektor (QCD, 15 μm bred) er forbundet gennem en 48 μm lang tilspidset SiN-baseret plasmonisk bølgeleder. Hel
Miniaturiseret lab-on-a-chip til kemisk analyse af væsker i realtidOn-chip sensorkoncept inklusive angivet plasmonisk tilstand. Emitter (QCL, 10 μm bred) og detektor (QCD, 15 μm bred) er forbundet gennem en 48 μm lang tilspidset SiN-baseret plasmonisk bølgeleder. Hel -
 Kollektiv adskillelse af sammenfiltrede polymererEt aktin filament i bevægelse. Kredit:C. Hohmann, NIM LMU-forskere har modbevist den konventionelle teori, der bruges til at forklare dynamikken i polymerløsninger. De viser, at for biopolymerer f
Kollektiv adskillelse af sammenfiltrede polymererEt aktin filament i bevægelse. Kredit:C. Hohmann, NIM LMU-forskere har modbevist den konventionelle teori, der bruges til at forklare dynamikken i polymerløsninger. De viser, at for biopolymerer f -
 Nær-infrarød spektroskopi kan forbedre fremstillingen af influenzavaccinerKredit:Sanofi Pasteur. Delt under en Creative Commons-licens. Nyere forskning fra North Carolina State University skitserer, hvordan nær-infrarød (NIR) spektroskopi kan bruges til at gøre fremstil
Nær-infrarød spektroskopi kan forbedre fremstillingen af influenzavaccinerKredit:Sanofi Pasteur. Delt under en Creative Commons-licens. Nyere forskning fra North Carolina State University skitserer, hvordan nær-infrarød (NIR) spektroskopi kan bruges til at gøre fremstil -
 Kræft målrettet med genanvendelig brændenældebehandlingRepræsentation af den organiske osmiumforbindelse, som udløses ved hjælp af en ikke-toksisk dosis natriumformiat, et naturligt produkt, der findes i mange organismer, herunder brændenælder og myrer. K
Kræft målrettet med genanvendelig brændenældebehandlingRepræsentation af den organiske osmiumforbindelse, som udløses ved hjælp af en ikke-toksisk dosis natriumformiat, et naturligt produkt, der findes i mange organismer, herunder brændenælder og myrer. K
- Springende og holdbare gummibelægninger kan redde tusinder af liv, siger forskere
- Hvorfor Arent moderne forstæder bygget på et gangbart gitter?
- Hvordan celler hurtigt skaber fremspring til udforskning og bevægelse
- Hvilken slags reaktion finder sted mellem calcium og EDTA?
- Hvilken type sedimenter bæres af tyngdekraften?
- Mønstre for kost og mobilitet i de sidste neandertalere og de første moderne mennesker


