En gas udøver et tryk på 0,892 atm i 5,00 L -beholder ved 15 grader celsius densiteten er 1,22 GL Hvilken molekylvægtgas?
1. Konverter temperatur til Kelvin:
* T (k) =t (° C) + 273.15
* T (k) =15 ° C + 273,15 =288,15 K
2. Brug den ideelle gaslov:
* PV =NRT
* P =tryk (atm) =0,892 atm
* V =volumen (L) =5,00 L
* n =antal mol
* R =ideel gaskonstant (0,0821 l · atm/mol · k)
* T =temperatur (k) =288,15 k
3. Løs for antallet af mol (n):
* n =(PV) / (RT)
* n =(0,892 atm * 5,00 L) / (0,0821 L · ATM / Mol · K * 288,15 K)
* n ≈ 0,199 mol
4. Beregn massen af gassen:
* Densitet =masse / volumen
* Masse =densitet * volumen
* Masse =1,22 g/l * 5,00 l =6,10 g
5. Bestem molekylvægten:
* Molekylvægt (m) =masse / mol
* M =6,10 g / 0,199 mol
* M ≈ 30,7 g/mol
Derfor er gasens molekylvægt ca. 30,7 g/mol.
Sidste artikelEt phosphoratom omgivet af fire iltatomer kaldes kombomly A?
Næste artikelHvad er reaktiviteten af lithium?
 Varme artikler
Varme artikler
-
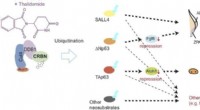 Molekylær basis for lægemiddelvirkninger på lemmer og øreudvikling afsløretThalidomid binder sig til cereblon (CRBN) og forårsager unormal lem- og øreudvikling ved at fremkalde nedbrydning af proteiner kaldet? Np63α og TAp63α gennem en proces kendt som ubiquitination. Denne
Molekylær basis for lægemiddelvirkninger på lemmer og øreudvikling afsløretThalidomid binder sig til cereblon (CRBN) og forårsager unormal lem- og øreudvikling ved at fremkalde nedbrydning af proteiner kaldet? Np63α og TAp63α gennem en proces kendt som ubiquitination. Denne -
 Fremkomsten af kiralitet og strukturel kompleksitet i enkeltkrystaller på det molekylære og morf…Scanning af elektronmikroskopi (SEM) billeder af yo-yo-lignende, enkeltkrystaller med et flerdomæne udseende. Hver side af jojo ligner en tusindfryd blomst. Kredit:Weizmann Institute of Science Fo
Fremkomsten af kiralitet og strukturel kompleksitet i enkeltkrystaller på det molekylære og morf…Scanning af elektronmikroskopi (SEM) billeder af yo-yo-lignende, enkeltkrystaller med et flerdomæne udseende. Hver side af jojo ligner en tusindfryd blomst. Kredit:Weizmann Institute of Science Fo -
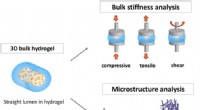 Semi-fleksibel modelbaseret analyse af celleadhæsion til hydrogelerSkematisk repræsentation af metoder til karakterisering af hydrogels fysiske egenskaber:hydrogels bulkstivhed og kædefleksibilitet i viskoelastiske netværk gennem den semi-fleksible model. Kredit: Vid
Semi-fleksibel modelbaseret analyse af celleadhæsion til hydrogelerSkematisk repræsentation af metoder til karakterisering af hydrogels fysiske egenskaber:hydrogels bulkstivhed og kædefleksibilitet i viskoelastiske netværk gennem den semi-fleksible model. Kredit: Vid -
 Vegansk edderkoppesilke giver et bæredygtigt alternativ til engangsplastikForskere har skabt en plantebaseret, bæredygtig, skalerbart materiale, der kunne erstatte engangsplast i mange forbrugerprodukter. Kredit:Xampla Forskere har skabt en plantebaseret, bæredygtig, sk
Vegansk edderkoppesilke giver et bæredygtigt alternativ til engangsplastikForskere har skabt en plantebaseret, bæredygtig, skalerbart materiale, der kunne erstatte engangsplast i mange forbrugerprodukter. Kredit:Xampla Forskere har skabt en plantebaseret, bæredygtig, sk
- Nordvestlige skove vil få flere og større naturbrande med klimaforandringerne
- Hvordan er jord en del af alle jordens sfærer?
- Forskere introducerer programmerbare materialer til at hjælpe med at helbrede brækkede knogler
- Ny forskning afslører betydningen af underjordiske flodmundinger for bæredygtigt fiskeri og akva…
- Hvad er den kemiske signatur for vand?
- Radiolevn fundet i en fusionerende galaksehob


