Molekylær basis for lægemiddelvirkninger på lemmer og øreudvikling afsløret
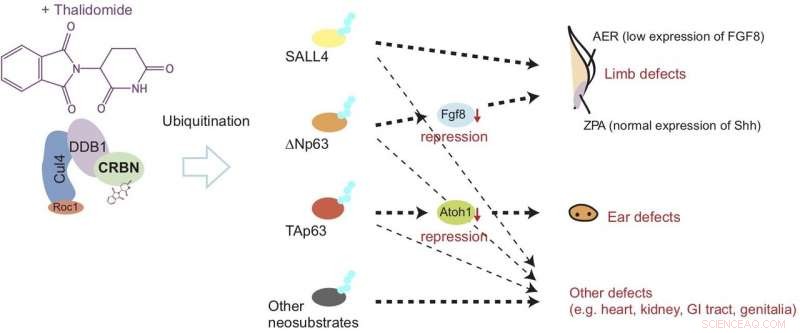
Thalidomid binder sig til cereblon (CRBN) og forårsager unormal lem- og øreudvikling ved at fremkalde nedbrydning af proteiner kaldet? Np63α og TAp63α gennem en proces kendt som ubiquitination. Denne model antyder, at defekterne udløses gennem nedregulering af vækstfaktorer kaldet Fgf8 og Atoh1. Kredit: Naturens kemiske biologi
Forskere i Japan og Italien har uddybet forståelsen for den måde, hvorpå thalidomid forårsager udviklingsmæssige abnormiteter på molekylært niveau. En international undersøgelse medforfattere af forskere ved Tokyo Institute of Technology (Tokyo Tech) og Tokyo Medical University har afsløret et detaljeret billede af, hvordan thalidomid, en af de mest berygtede lægemidler, der nogensinde er udviklet, forårsager abnormiteter i lemmer og øreudvikling. Resultaterne kan bidrage til genopståelsen af sikre, eller ikke-teratogen, thalidomid-afledte lægemidler som behandling af kræft og inflammatoriske sygdomme.
Oprindeligt brugt i slutningen af 1950'erne som behandling mod morgenkvalme, beviser i begyndelsen af 1960'erne knyttet thalidomid til abnormiteter, herunder forkortede lemmer og defekte organer, hvilket førte til dens forbud over hele verden. Bemærkelsesværdigt, baseret på efterfølgende fund, der fremhævede thalidomids antiinflammatoriske og andre gavnlige egenskaber, stoffet er blevet et vigtigt eksempel på et, der kan genanvendes til behandling af tilstande som spedalskhed og myelomatose, en form for blodkræft.
"Thalidomid-tragedien er ikke en åben og lukket sag i medicinsk historie, men er i gang, da nye thalidomidbabyer er blevet født efter det blev godkendt igen omkring 2000, "forklarer biokemiker Yuki Yamaguchi fra Tokyo Tech." Men vi ved nu, at thalidomid og dets afledte lægemidler er yderst effektive og er forbundet med få bivirkninger, bortset fra de teratogene virkninger på fosteret, i modsætning til mange andre konventionelle kræftbekæmpende midler. Derfor, teratogenicitet er stadig en stor hindring for bredere anvendelse af disse lovende lægemidler. "
For at undersøge mekanismerne bag thalidomidaktivitet mere detaljeret, Yamaguchi samarbejdede med Hiroshi Handa fra Tokyo Medical University, Luisa Guerrini fra Universita degli Studi di Milano, Italien, og andre til at gennemføre udviklingsstudier ved hjælp af zebrafisk som modelorganisme. Dette samarbejde gik ud på at undersøge Guerrinis antagelse om, at p63 -familien af proteiner kan være kritisk involveret. I 2010, et team ledet af Handa og Yamaguchi opnåede et gennembrud ved at identificere cereblon som et vigtigt protein, hvorigennem thalidomid initierer dets negative eller teratogene virkninger.
Nu, den seneste undersøgelse offentliggjort i Naturens kemiske biologi viser, at efter binding til cereblon, thalidomid forårsager skader på finner (svarende til lemmer) og otiske vesikler (svarende til ører) ved at forårsage nedbrydning af to typer p63 -protein. Specifikt, undersøgelsen tyder på, at nedbrydningen af ΔNp63α resulterer i lemfejl, mens TAp63α fører til ørefejl, som vist i figur 1.
At forstå, hvordan cereblon virker til at formidle virkningerne af thalidomid, kan ændre den måde, medicin udvikles på - bevæge sig væk fra serendipitøs opdagelse og mod rationelt molekylært design. "Ændringen ville være som et skift fra at lede efter en nål i en høstak til at skære en nål ud af knogler, "Bemærker Yamaguchi.
"Det er sandsynligt, at vi vil se udviklingen af nye thalidomidbaserede lægemidler uden teratogene virkninger i den nærmeste fremtid, " han siger.
 Varme artikler
Varme artikler
-
 Præcis definerede polymerkæder er nu en realitetDen nye molekyleforbindelsesteknik kan forestilles som tre adskilte jernbanevogne, hver har to unikke koblinger i hver ende, kun tillader dem at blive koblet i en bestemt rækkefølge. Kredit:Takeharu H
Præcis definerede polymerkæder er nu en realitetDen nye molekyleforbindelsesteknik kan forestilles som tre adskilte jernbanevogne, hver har to unikke koblinger i hver ende, kun tillader dem at blive koblet i en bestemt rækkefølge. Kredit:Takeharu H -
 Spider dragline silke som torsionsaktuator drevet af fugt til applikationer som kunstig muskelI undersøgelsen, Liu et al. brugte dragline silke fra den afbildede edderkoppeart Nephila eduli, Nephila pilipes og Argiope versicolor. Billedkredit:Spider ID (spiderid.com/pictures/?fwp_attributes=we
Spider dragline silke som torsionsaktuator drevet af fugt til applikationer som kunstig muskelI undersøgelsen, Liu et al. brugte dragline silke fra den afbildede edderkoppeart Nephila eduli, Nephila pilipes og Argiope versicolor. Billedkredit:Spider ID (spiderid.com/pictures/?fwp_attributes=we -
 Sorghum:Helsekost, sødemiddel og nu, farvestof til tøjBrune tøjfarver fremstillet af sorghumskaller (øverste række) matcher nøje farverne på syntetiske farvestoffer (nederste række). Kredit:American Chemical Society Sorghum har længe været en basisfø
Sorghum:Helsekost, sødemiddel og nu, farvestof til tøjBrune tøjfarver fremstillet af sorghumskaller (øverste række) matcher nøje farverne på syntetiske farvestoffer (nederste række). Kredit:American Chemical Society Sorghum har længe været en basisfø -
 Teamdetaljer plasmonisk effekt, der gør det muligt for katalysatoren at arbejde med lavere energiKandidatstuderende Linan Zhou fra Rice Universitys Laboratory for Nanophotonics brugte måneder på at tage omhyggelige målinger af lysaktiverede katalysatorer. Forskningen, som vises i Science magazine
Teamdetaljer plasmonisk effekt, der gør det muligt for katalysatoren at arbejde med lavere energiKandidatstuderende Linan Zhou fra Rice Universitys Laboratory for Nanophotonics brugte måneder på at tage omhyggelige målinger af lysaktiverede katalysatorer. Forskningen, som vises i Science magazine
- En model forklarer effekter som dannelsen af skyer fra havet
- Fremskridt peger vejen til mindre, sikrere batterier
- Indiens ambitiøse planer om at opnå sanitet for alle må se ud over at bygge individuelle toilette…
- Hvad er tabte kontinenter, og hvorfor opdager vi så mange?
- Arbejdsløshedsydelser nåede kun ud til en fjerdedel af de afskedigede arbejdstagere
- Moderne videnskab afslører gammel hemmelighed i japansk litteratur


