Hvad er den molekylære formel for en forbindelse med en empirisk CH?
For at bestemme den molekylære formel har vi brug for yderligere oplysninger, specifikt molmassen af forbindelsen.
Sådan kan vi finde den molekylære formel:
1. Beregn den empiriske formelmasse:
- C:12,01 g/mol
- H:1,01 g/mol
- Empirisk formelmasse =12,01 + 1,01 =13,02 g/mol
2. Opdel den molære masse af forbindelsen med den empiriske formelmasse:
- Dette giver dig et helt tal, som er den faktor, hvormed den empiriske formel skal multipliceres for at få molekylformlen.
Eksempel:
Lad os sige, at forbindelsens molære masse er 78,12 g/mol.
- 78,12 g/mol/13,02 g/mol =6
Dette betyder, at den molekylære formel er seks gange den empiriske formel:
- molekylær formel:C6H6
Uden at kende den molære masse, kan vi ikke bestemme den molekylære formel. Der er mange mulige molekylære formler med den empiriske formel CH, såsom:
* C2H2 (acetylen)
* C4H4
* C6H6 (benzen)
* C8H8
* og så videre.
Sidste artikelHvad er strukturen af cæsiumchlorid?
Næste artikelEr ALP en ionisk eller molekylær forbindelse?
 Varme artikler
Varme artikler
-
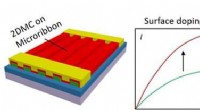 2-D molekylære krystaller, der modulerer elektroniske egenskaber af organiske halvledereSkema af den nederste port, topkontakt OFETer baseret på 1D/2D sammensatte enkeltkrystaller og skematisk diagram af I-V kurver før og efter doping. Kredit:Science China Press Organiske felteffektt
2-D molekylære krystaller, der modulerer elektroniske egenskaber af organiske halvledereSkema af den nederste port, topkontakt OFETer baseret på 1D/2D sammensatte enkeltkrystaller og skematisk diagram af I-V kurver før og efter doping. Kredit:Science China Press Organiske felteffektt -
 Nyt værktøj til at bekæmpe terrorismeDna retsmedicinsk forskningsassocieret Dr. Jennifer Young tager miljøstøvprøver fra ejendele til det nye forsøg på Flinders University. Kredit:Flinders University Retsmedicinske eksperter ved Flin
Nyt værktøj til at bekæmpe terrorismeDna retsmedicinsk forskningsassocieret Dr. Jennifer Young tager miljøstøvprøver fra ejendele til det nye forsøg på Flinders University. Kredit:Flinders University Retsmedicinske eksperter ved Flin -
 Solmateriale kan selvhelbredende ufuldkommenheder, viser ny forskningKredit:CC0 Public Domain Et materiale, der kan bruges i teknologier som solenergi, har vist sig at selvhelbredende, viser en ny undersøgelse. Resultaterne - fra University of York - rejser udsigt
Solmateriale kan selvhelbredende ufuldkommenheder, viser ny forskningKredit:CC0 Public Domain Et materiale, der kan bruges i teknologier som solenergi, har vist sig at selvhelbredende, viser en ny undersøgelse. Resultaterne - fra University of York - rejser udsigt -
 Udnytter kraften i CRISPR-Cas9 til at vække antibiotika fra deres tavse genklyngerLille forstyrrelse, stor indvirkning:Antibiotikum, auroramycin, blev vækket gennem CRISPR-Cas9-promotorens knock-in-strategi. Kredit:A*STAR Institute of Chemical and Engineering Sciences Bakterien
Udnytter kraften i CRISPR-Cas9 til at vække antibiotika fra deres tavse genklyngerLille forstyrrelse, stor indvirkning:Antibiotikum, auroramycin, blev vækket gennem CRISPR-Cas9-promotorens knock-in-strategi. Kredit:A*STAR Institute of Chemical and Engineering Sciences Bakterien
- Forskere løser mysteriet om, hvordan det meste antistof i Mælkevejen dannes
- Hvad er den proces, hvorved planter omdanner kuldioxid til energirige forbindelser?
- Hvad er dengang to hovedafdeling for videnskab?
- Vibrerende nanorods måler tynde film til mikrokredsløb
- Hvordan påvirker den tætte nærhed af Merkur til solen dets egenskaber og adfærd?
- Grønning af kvarterer kan føre til gentrificering og forskydning


