Hvad er strukturen af cæsiumchlorid?
Nøglefunktioner:
* enhedscelle: Enhedscellen på CSCL er en enkel terning .
* gitterpunkter: Der er to gitterpunkter pr. Enhedscelle:
* En cs⁺ion i midten af terningen.
* En cl⁻ion i et af hjørnerne af terningen.
* Koordinationsnummer: Både CS⁺ og CL⁻ioner har et koordinationsnummer på 8 . Dette betyder, at hver cs⁺ion er omgivet af 8 cl⁻ioner og vice versa.
* støkiometri: Enhedscellen afspejler perfekt 1:1 støkiometri af CSCL.
visuel repræsentation:
Du kan visualisere strukturen som:
* En Cl⁻ion i midten af en terning med otte CS⁺ -ioner i hjørnerne af terningen.
* Forestil dig alternativt en cs⁺ion i midten af en terning med otte cl⁻ioner i hjørnerne.
Bemærk: Mens CSCL -strukturen er opkaldt efter forbindelsen, vedtager mange andre ioniske forbindelser som NaCl ved højt tryk også denne struktur.
Vigtige overvejelser:
* CSCL -strukturen er kun stabil for ioniske forbindelser med en relativt stor kation og en relativt lille anion. Dette skyldes, at den store cs⁺ion har brug for plads til at rumme otte Cl⁻ioner omkring det.
* CSCL -strukturen er en primitiv kubisk gitter , hvilket betyder, at der ikke er nogen atomer i ansigtscentre i terningen.
Fortæl mig, hvis du gerne vil have en mere detaljeret forklaring af et specifikt aspekt af CSCL -strukturen!
Sidste artikelHvad er formlen for cesiumsulfat?
Næste artikelHvad er den molekylære formel for en forbindelse med en empirisk CH?
 Varme artikler
Varme artikler
-
 Skibe glider i en luftkuvertKomplekse biomimetiske strukturer bevarer luften under vand. Luften på den faktisk blå bærer fremstår sølvfarvet under vand. Kredit:Thomas Schimmel, SÆT Friktion, korrosion, og biofilm er tre stor
Skibe glider i en luftkuvertKomplekse biomimetiske strukturer bevarer luften under vand. Luften på den faktisk blå bærer fremstår sølvfarvet under vand. Kredit:Thomas Schimmel, SÆT Friktion, korrosion, og biofilm er tre stor -
 Forskere har låst op for hemmeligheder om konstrueret proteinreceptor, BILIllustration af kimærisk antigenreceptor (CAR). Kredit:Madelin Lum/ USC Viterbi School of Engineering Kræft er fortsat den næstførende dødsårsag i USA. Dette år, anslået 1,7 millioner nye tilfælde
Forskere har låst op for hemmeligheder om konstrueret proteinreceptor, BILIllustration af kimærisk antigenreceptor (CAR). Kredit:Madelin Lum/ USC Viterbi School of Engineering Kræft er fortsat den næstførende dødsårsag i USA. Dette år, anslået 1,7 millioner nye tilfælde -
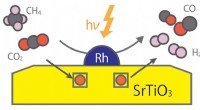 Miljøvenlig katalysator til omdannelse af metan til nyttige gasser ved hjælp af lys i stedet for v…Strontiumtitanat kombineret med rhodiumnanopartikler omdannede metan og kuldioxid til syntesegas under lysbestråling ved meget lavere temperaturer end dem, der kræves i termiske reaktorer. Kredit:Toky
Miljøvenlig katalysator til omdannelse af metan til nyttige gasser ved hjælp af lys i stedet for v…Strontiumtitanat kombineret med rhodiumnanopartikler omdannede metan og kuldioxid til syntesegas under lysbestråling ved meget lavere temperaturer end dem, der kræves i termiske reaktorer. Kredit:Toky -
 Foryngende metallisk glas for at forhindre brudForyngelse og deformation af en MG. Kredit: Natur (2020). DOI:10.1038/s41586-020-2016-3 Et team af forskere fra det kinesiske videnskabsakademi og University of Cambridge har fundet en måde at fo
Foryngende metallisk glas for at forhindre brudForyngelse og deformation af en MG. Kredit: Natur (2020). DOI:10.1038/s41586-020-2016-3 Et team af forskere fra det kinesiske videnskabsakademi og University of Cambridge har fundet en måde at fo
- Hvor mange gange er stor solen fra månen?
- Forskere bruger CARC-systemer til at forstå vulkanformer
- Koboltpriserne stiger, men Congos små minearbejdere ser lidt af gevinsten
- Fjernovervågning hjælper med at finde løsninger på crapemyrtle bark scale
- Hvad er antallet af protoner til Florine?
- Hvordan kan vi effektivt forbedre og bruge saltvand-alkalijord til at sikre fødevaresikkerhed?


