Hvorfor ændrer kobbersulfatmasse, når de opvarmes?
* krystallisationsvand: Kobbersulfatpentahydrat indeholder fem vandmolekyler bundet til hvert kobbersulfatmolekyle. Disse vandmolekyler er ikke kemisk bundet, men holdes snarere i krystalstrukturen gennem svage kræfter.
* dehydrering: Når du opvarmer kobbersulfatpentahydrat, giver du energi til at bryde disse svage bindinger. Vandmolekylerne undslipper som vanddamp og efterlader vandfri kobbersulfat (cuso₄).
* farveændring: Vandfarvet kobbersulfat er et hvidt pulver, der kontrasterer med den blå farve på den hydratiserede form. Denne farveændring er en visuel indikator for dehydreringsprocessen.
* massetab: Da vandmolekyler går tabt under opvarmningen, falder prøven af prøven. Mængden af mistet masse svarer til massen af vandet, der blev fordampet.
Her er en simpel ligning, der repræsenterer processen:
Cuso₄ · 5H₂o (blå, hydreret) → cuso₄ (hvid, vandfri) + 5h₂o (vanddamp)
Nøglepunkter:
* Ændringen i masse er direkte relateret til den mistede mængde vand.
* Processen er reversibel; Du kan rehydrere det vandfri kobbersulfat ved at tilsætte vand, og det vil blive blåt igen.
* Denne egenskab af kobbersulfat anvendes i forskellige anvendelser, herunder som et tørremiddel (tørringsmiddel) og i kemiske eksperimenter for at illustrere begrebet hydrering og dehydrering.
Sidste artikelHvor mange atomer med hydrogener er i 3 mol CH4?
Næste artikelHvad er farve på cæsiumchlorid?
 Varme artikler
Varme artikler
-
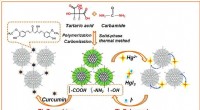 Hvordan nitrogen-doterede fluorescerende kulstofprikker hjælper kampen mod sygdomSkematisk diagram af forberedelses- og responsmekanismen for NCDer. Kredit:Wei Chen Evnen til pålideligt og præcist at detektere niveauer af iodidion og curcumin er afgørende inden for fødevare- o
Hvordan nitrogen-doterede fluorescerende kulstofprikker hjælper kampen mod sygdomSkematisk diagram af forberedelses- og responsmekanismen for NCDer. Kredit:Wei Chen Evnen til pålideligt og præcist at detektere niveauer af iodidion og curcumin er afgørende inden for fødevare- o -
 Krystaløer kan halvere tid og omkostninger ved videnskabelige eksperimenterEn siliciumprøve renses med høj temperatur, i et Omicron VT-AFM/XA multifunktionssystem. Kredit:QUT QUT-forskere har fundet en måde at dyrke krystaløer på, som kan halvere tiden og omkostningerne
Krystaløer kan halvere tid og omkostninger ved videnskabelige eksperimenterEn siliciumprøve renses med høj temperatur, i et Omicron VT-AFM/XA multifunktionssystem. Kredit:QUT QUT-forskere har fundet en måde at dyrke krystaløer på, som kan halvere tiden og omkostningerne -
 Effektiv optagelse af uran (VI) realiseret af lagdelt manganthiophosphit interkaleret med ammoniumSkematisk diagram over det lagdelte MnPS 3 interkaleret med NH 4 + (N-MPS) til indfangning af U (VI). Kredit:Prof. Huangs gruppe Med den hurtige udvikling af atomkraft på verdensplan, efters
Effektiv optagelse af uran (VI) realiseret af lagdelt manganthiophosphit interkaleret med ammoniumSkematisk diagram over det lagdelte MnPS 3 interkaleret med NH 4 + (N-MPS) til indfangning af U (VI). Kredit:Prof. Huangs gruppe Med den hurtige udvikling af atomkraft på verdensplan, efters -
 Fysikere udvikler en ny metode til at identificere antibiotika-resistente bakterierHolder med prøver af mykobakteriestammer med forskellig antibiotikaresistens. Kredit:Andrey Zyubin Et hold fysikere fra Immanuel Kant Baltic State University har foreslået en metode til at identif
Fysikere udvikler en ny metode til at identificere antibiotika-resistente bakterierHolder med prøver af mykobakteriestammer med forskellig antibiotikaresistens. Kredit:Andrey Zyubin Et hold fysikere fra Immanuel Kant Baltic State University har foreslået en metode til at identif
- Hvilket grundstof i periode 3 har den laveste første ioniseringsenergi?
- 5 tips til at forblive sikre under en varmebølge
- Forskere bruger grønt guld til hurtigt at opdage og identificere skadelige bakterier
- Hardware-software co-design tilgang kunne gøre neurale netværk mindre strømkrævende
- Fem etiske spørgsmål til, hvordan vi vælger at bruge månen
- Twitter forbyder dehumaniserende kommentarer med brugerhjælp


