Hvorfor er magnesiumhydroxid et bedre antacida end natriumhydroxid?
1. Neutraliseringskapacitet:
* magnesiumhydroxid: Det er en svag base, hvilket betyder, at den neutraliserer mavesyre (saltsyre, HCI) mindre aggressivt end en stærk base som natriumhydroxid. Denne blødere neutralisering hjælper med at forhindre rebound -effekten, hvor maven overkompenserer ved at producere endnu mere syre efter at have taget antacida.
* natriumhydroxid: En stærk base, der neutraliserer mavesyre hurtigt og fuldstændigt. Dette kan føre til en hurtig stigning i pH, hvilket potentielt kan forårsage irritation og ubehag.
2. Sikkerhed:
* magnesiumhydroxid: Relativt sikkert til konsum, selv i større doser. Det er mindre tilbøjeligt til at forårsage elektrolytubalance eller andre bivirkninger.
* natriumhydroxid: Ekstremt kaustisk og kan forårsage alvorlige forbrændinger i munden, halsen og maven, hvis de indtages. Det er meget farligt og bør aldrig bruges som antacida.
3. Opløselighed:
* magnesiumhydroxid: Lidt opløselig i vand, hvilket hjælper med at opretholde en gradvis neutralisering af mavesyre.
* natriumhydroxid: Meget opløselig i vand, hvilket fører til hurtig og potentielt skadelig neutralisering.
4. Bivirkninger:
* magnesiumhydroxid: Kan forårsage milde bivirkninger såsom diarré eller forstoppelse, afhængigt af individet.
* natriumhydroxid: Kan forårsage alvorlige og potentielt livstruende bivirkninger, herunder forbrændinger, opkast og intern blødning.
Kortfattet:
Magnesiumhydroxid foretrækkes som et antacida på grund af dets blødere neutralisering, sikkerhed og mindre alvorlige bivirkninger sammenlignet med natriumhydroxid. Natriumhydroxid er meget farlig og bør aldrig bruges til dette formål.
 Varme artikler
Varme artikler
-
 Når et porøst fast stof bevarer sine egenskaber i flydende formKrystallinsk struktur af ZIF-4-materialet ved stuetemperatur. Kredit:F.-X. Coudert / CNRS Kendt for deres enestående porøsitet, der muliggør indfangning eller transport af molekyler, metal-organis
Når et porøst fast stof bevarer sine egenskaber i flydende formKrystallinsk struktur af ZIF-4-materialet ved stuetemperatur. Kredit:F.-X. Coudert / CNRS Kendt for deres enestående porøsitet, der muliggør indfangning eller transport af molekyler, metal-organis -
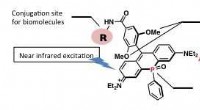 Et nær-infrarødt fluorescerende farvestof til langsigtet biobilleddannelseMolekylær struktur af det nye nær-infrarøde fluorescerende mærkningsmiddel PREX 710 med et koblingssted for et biomolekyle. Inkorporering af den elektrontiltrækkende phosphinoxid (P=O)-del i xanthenst
Et nær-infrarødt fluorescerende farvestof til langsigtet biobilleddannelseMolekylær struktur af det nye nær-infrarøde fluorescerende mærkningsmiddel PREX 710 med et koblingssted for et biomolekyle. Inkorporering af den elektrontiltrækkende phosphinoxid (P=O)-del i xanthenst -
 Undersøgelse opdager nyt leveringssystem, der kan hjælpe med at forhindre bakterielle infektionerKredit:CC0 Public Domain I en nylig undersøgelse i Journal of The American Chemical Society , Professor Tewodros Asefa og lektor Jeffrey Boyd syntetiserede nanostrukturerede silicapartikler, ans
Undersøgelse opdager nyt leveringssystem, der kan hjælpe med at forhindre bakterielle infektionerKredit:CC0 Public Domain I en nylig undersøgelse i Journal of The American Chemical Society , Professor Tewodros Asefa og lektor Jeffrey Boyd syntetiserede nanostrukturerede silicapartikler, ans -
 Eliminerer revner i 3-D-printede metalkomponenterKredit:istock Forskere ved EPFL har udviklet en ny laser 3-D-printteknik til fremstilling af metalkomponenter med hidtil uset modstandsdygtighed over for høje temperaturer, skader og korrosion. Me
Eliminerer revner i 3-D-printede metalkomponenterKredit:istock Forskere ved EPFL har udviklet en ny laser 3-D-printteknik til fremstilling af metalkomponenter med hidtil uset modstandsdygtighed over for høje temperaturer, skader og korrosion. Me


