Hvorfor er kuldioxid ikke-polært?
* symmetri: Molekylet er perfekt symmetrisk. De to iltatomer trækker på elektronerne i bindingerne lige og i modsatte retninger.
* Elektronegativitet: Oxygen er mere elektronegativ end kulstof. Dette betyder, at ilt tiltrækker de delte elektroner i bindingerne stærkere, hvilket skaber en delvis negativ ladning (Δ-) på hvert iltatom og en delvis positiv ladning (Δ+) på carbonatomet.
* annullering af dipolmomenter: Selvom hver C-O-binding er polær (på grund af elektronegativitetsforskellen), får det symmetriske arrangement af molekylet disse dipoler til at annullere hinanden.
Tænk på det sådan: Forestil dig to tug-af-krigshold, der trækker med lige styrke i modsatte retninger. Rebet bevæger sig ikke, fordi kræfterne balanserer. Tilsvarende annullerer dipolmomenterne i co₂ hinanden, hvilket resulterer i en ikke-polær molekyle.
 Varme artikler
Varme artikler
-
 Udvinding af dyrebare sjældne jordarters grundstoffer fra kulflyveaske med en genanvendelig ionisk …Kredit:Grant Wilson/public domain Sjældne jordarters elementer er i mange hverdagsprodukter, såsom smartphones, LED lys og batterier. Imidlertid, kun nogle få steder har store forekomster, der er
Udvinding af dyrebare sjældne jordarters grundstoffer fra kulflyveaske med en genanvendelig ionisk …Kredit:Grant Wilson/public domain Sjældne jordarters elementer er i mange hverdagsprodukter, såsom smartphones, LED lys og batterier. Imidlertid, kun nogle få steder har store forekomster, der er -
 Grønt protein uden smag af kostaldKredit:Miriam Meister Forskere fra DTU Fødevarer har udviklet en teknik til at udvinde protein fra grøn biomasse uden uønsket bismag. Køer kan lide græs for at smage som græs. Imidlertid, hvis fo
Grønt protein uden smag af kostaldKredit:Miriam Meister Forskere fra DTU Fødevarer har udviklet en teknik til at udvinde protein fra grøn biomasse uden uønsket bismag. Køer kan lide græs for at smage som græs. Imidlertid, hvis fo -
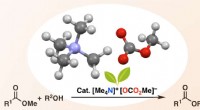 Metalfri katalysator udvider rækkevidden af estersynteseTetramethylammoniummethylcarbonat (TMC) reagerer in situ med en alkohol for at danne en alkoxidion, som derefter angriber startesteren for at give den komplekse målester i høje udbytter. Kredit:Manabu
Metalfri katalysator udvider rækkevidden af estersynteseTetramethylammoniummethylcarbonat (TMC) reagerer in situ med en alkohol for at danne en alkoxidion, som derefter angriber startesteren for at give den komplekse målester i høje udbytter. Kredit:Manabu -
 Slangearter fra forskellige terræn overgiver overfladehemmeligheder bag glidende succesKredit:Pixabay/CC0 Public Domain Nogle slangearter glider hen over jorden, mens andre klatrer i træer, dykke gennem sand eller glide hen over vandet. I dag, forskere rapporterer, at overfladekemie
Slangearter fra forskellige terræn overgiver overfladehemmeligheder bag glidende succesKredit:Pixabay/CC0 Public Domain Nogle slangearter glider hen over jorden, mens andre klatrer i træer, dykke gennem sand eller glide hen over vandet. I dag, forskere rapporterer, at overfladekemie
- Data fra MAXI J1820+070 viser, at Einstein havde ret i, hvordan stof dykker ned i et sort hul
- Den amerikanske fintech-gigant FIS køber betalingsfirmaet Worldpay
- Biomaterialer til regenerering af knogle- og bruskvæv fra æbleaffald
- Arktisk rejse finder global opvarmning indvirkning på is, dyr
- Hvad er antallet af neutroner i bor?
- Sådan beregnes kugle størrelse


