Hvilken type obligation vil der dannes to ikke -metaller?
Her er hvorfor:
* ikke -metaller Har en høj elektronegativitet, hvilket betyder, at de har en stærk attraktion for elektroner.
* kovalente obligationer Involver deling af elektroner mellem atomer.
* Da begge ikke -metaller har et stærkt træk på elektroner, er de mest sandsynligt, at de deler elektroner snarere end den ene fuldstændigt overfører et elektron til det andet (hvilket er, hvad der sker i ioniske bindinger).
Eksempler på kovalente bindinger mellem ikke -metaller:
* Oxygen (O2) - Dobbelt kovalent binding
* Vand (H2O) - Enkelt kovalente bindinger
* Kuldioxid (CO2) - Dobbelt kovalente bindinger
* Methan (CH4) - Enkelt kovalente bindinger
 Varme artikler
Varme artikler
-
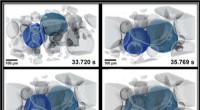 Ny verdensrekord i materialeforskning:røntgenmikroskopi med en hastighed på 1000 tomogram pr.Sådanne metalskum baseret på aluminiumslegeringer undersøges som letvægtsmaterialer, for eksempel til konstruktion af elbiler. Morfologien, størrelse og tværbinding af boblerne er vigtige for at opnå
Ny verdensrekord i materialeforskning:røntgenmikroskopi med en hastighed på 1000 tomogram pr.Sådanne metalskum baseret på aluminiumslegeringer undersøges som letvægtsmaterialer, for eksempel til konstruktion af elbiler. Morfologien, størrelse og tværbinding af boblerne er vigtige for at opnå -
 Enkeltelektrodemateriale strømliner funktioner til en lille chipDenne illustration viser elektrokemisk energilagring på chip integreret med tyndfilmselektronik på transistorniveau ved hjælp af et enkelt-elektrodemateriale til alle enheder. Kredit:WILEY‐VCH Verlag
Enkeltelektrodemateriale strømliner funktioner til en lille chipDenne illustration viser elektrokemisk energilagring på chip integreret med tyndfilmselektronik på transistorniveau ved hjælp af et enkelt-elektrodemateriale til alle enheder. Kredit:WILEY‐VCH Verlag -
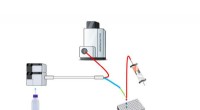 Nanofraktioneringsplatform med parallel massespecifikation til ID cytochrom CYP1A2-hæmmereGenerering af fase I metabolisk blanding af et lægemiddel efterfølges af kromatografisk adskillelse af metabolitterne. En split leder eluent til MS til identifikation af forbindelsen og til nanofrakti
Nanofraktioneringsplatform med parallel massespecifikation til ID cytochrom CYP1A2-hæmmereGenerering af fase I metabolisk blanding af et lægemiddel efterfølges af kromatografisk adskillelse af metabolitterne. En split leder eluent til MS til identifikation af forbindelsen og til nanofrakti -
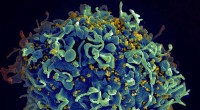 Når HIV-medicin ikke samarbejderHIV inficerer en menneskelig celle. Kredit:NIH Udtrykket synergi har fået et ry som et overbrugt buzzword, men det har en kvantificerbar definition i farmakologi. To lægemidler anses for synergist
Når HIV-medicin ikke samarbejderHIV inficerer en menneskelig celle. Kredit:NIH Udtrykket synergi har fået et ry som et overbrugt buzzword, men det har en kvantificerbar definition i farmakologi. To lægemidler anses for synergist
- Hvilke planeter har en tyk atmosfære?
- Planteressourcer truet af skadedyr og sygdomme
- Hvad er volumen af 495g eller ethanol?
- Ny undersøgelse modsiger antagelser om konstante grundstofforhold i havene
- Er MLB klar til at konkurrere om næste generation af fans?
- Forskning kan dramatisk sænke omkostningerne ved elektronkilder


