Hvad er bindingsvinklen på CS2 -molekyle?
Her er hvorfor:
* lineær geometri: CS₂ har en lineær molekylær geometri. Dette betyder, at molekylet er lige med carbonatomet i midten og de to svovlatomer på hver side.
* Hybridisering: Carbonatomet i CS₂ gennemgår SP -hybridisering. Dette resulterer i to SP -hybrid -orbitaler, der er orienteret 180 ° fra hinanden. Disse orbitaler danner sigma -bindinger med de to svovlatomer.
* Ingen ensomme par: Det centrale carbonatom har ingen ensomme par elektroner. Dette gør det muligt for molekylet at opretholde sin lineære geometri.
Derfor er bindingsvinklen i CS₂ 180 °.
Sidste artikelEr kuldioxid en ionisk binding?
Næste artikelHvad er bindingsvinklen mellem iltatomer i kuldioxidmolekyle?
 Varme artikler
Varme artikler
-
 Tager gætværket ud af retsmedicinsk analyse af fingermærkerForskere bruger infrarøde lasere til at løfte fingeraftryk fra gerningssteder. Kredit:LSU Forskere ved Louisiana State University Department of Chemistry, herunder postdoc-forsker Fabrizio Donnaru
Tager gætværket ud af retsmedicinsk analyse af fingermærkerForskere bruger infrarøde lasere til at løfte fingeraftryk fra gerningssteder. Kredit:LSU Forskere ved Louisiana State University Department of Chemistry, herunder postdoc-forsker Fabrizio Donnaru -
 Nyt værktøj kan hjælpe forskere med at identificere enzymer i mikrobiomerKredit:Kris Snibbe/Harvard University For forskere, der studerer de mulige forbindelser mellem menneskers sundhed og de billioner af mikrober, der bebor vores fordøjelseskanal, det, der gør arbejd
Nyt værktøj kan hjælpe forskere med at identificere enzymer i mikrobiomerKredit:Kris Snibbe/Harvard University For forskere, der studerer de mulige forbindelser mellem menneskers sundhed og de billioner af mikrober, der bebor vores fordøjelseskanal, det, der gør arbejd -
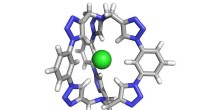 Opbygning af en bedre saltlås:Forskere syntetiserer et molekylærbur for at fange kloridEn computergengivelse af seks-triazolmolekyleburet designet til at fange kloridsalte. Kredit:Yan Liu, University of Illinois i Urbana-Champaign Indiana University forskere har skabt et kraftfuldt
Opbygning af en bedre saltlås:Forskere syntetiserer et molekylærbur for at fange kloridEn computergengivelse af seks-triazolmolekyleburet designet til at fange kloridsalte. Kredit:Yan Liu, University of Illinois i Urbana-Champaign Indiana University forskere har skabt et kraftfuldt -
 Ny model måler karakteristika af kulstof-nanorørstrukturer til energilagring og vandafsaltningEvelyn Wang (til venstre) og Heena Mutha har udviklet en ikke-destruktiv metode til at kvantificere de detaljerede karakteristika af carbon nanorør (CNT) prøver - et værdifuldt værktøj til at optimere
Ny model måler karakteristika af kulstof-nanorørstrukturer til energilagring og vandafsaltningEvelyn Wang (til venstre) og Heena Mutha har udviklet en ikke-destruktiv metode til at kvantificere de detaljerede karakteristika af carbon nanorør (CNT) prøver - et værdifuldt værktøj til at optimere
- Fire nye DAQ hvide dværge opdaget
- Hvad sker der med den kinetiske energi i en bil, når den bremses stop?
- Holdbar belægning dræber COVID-virus og andre bakterier på få minutter
- Mexicansk anti-fattigdomsprogram rettet mod fattige kvinder kan hjælpe mænd mest, undersøgelse fi…
- Nye magnetiske egenskaber låst op til fremtidige spintronic -applikationer
- Hvad er typen af kraft i en stangmagnet ophængt frit?


