Hvad er molariteten af en 3,0 procent hydrogenperoxid H2O2 vandig opløsning, når densiteten i det væsentlige er 1,0 g over ML?
1. Forståelsen af oplysningerne:
* 3,0% hydrogenperoxid: Dette betyder, at 100 g af opløsningen indeholder 3,0 g H₂O₂.
* densitet på 1,0 g/ml: Dette fortæller os, at 1 ml af opløsningen vejer 1 g.
2. Beregning af molaritet:
* molmasse af H₂O₂: 2 (1,01 g/mol) + 2 (16,00 g/mol) =34,02 g/mol
* masse af H₂O₂ i 1 L Opløsning: Da densiteten er 1,0 g/ml, vejer 1 l (1000 ml) opløsning 1000 g. Derfor indeholder 1 L -opløsning (3,0 g H₂O₂ / 100 g opløsning) * 1000 g opløsning =30 g H₂O₂.
* mol H₂O₂ i 1 L Opløsning: (30 g H₂O₂) / (34,02 g / mol) =0,882 mol H₂O₂
* Molaritet (M): Molaritet defineres som mol af opløst stof pr. Liter opløsning. Derfor er molariteten af opløsningen 0,882 mol/l eller 0,882 M.
Derfor er molariteten af en 3,0% hydrogenperoxid vandig opløsning ca. 0,882 m.
 Varme artikler
Varme artikler
-
 Team opdager lysdrevne katalysatorer, der danner olefiner til medicin, landbrugskemisk fremstillingOrganismer, der trives nær varme havåbninger, inspirerede en teknik af forskere fra Rice University, der bruger lys til at udløse et B12 -vitamin, der findes i thermus thermophilus, til at katalysere
Team opdager lysdrevne katalysatorer, der danner olefiner til medicin, landbrugskemisk fremstillingOrganismer, der trives nær varme havåbninger, inspirerede en teknik af forskere fra Rice University, der bruger lys til at udløse et B12 -vitamin, der findes i thermus thermophilus, til at katalysere -
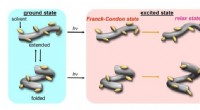 Under tryk:Manipulering af protein-efterlignende molekyler med hydrostatisk trykI grundtilstanden, værten vedtager to konformere, en forlænget og en foldet, og gradvist skifter til en udvidet-rig tilstand efter tryk. Derefter, i ophidset tilstand (hυ), disse to konformere udsende
Under tryk:Manipulering af protein-efterlignende molekyler med hydrostatisk trykI grundtilstanden, værten vedtager to konformere, en forlænget og en foldet, og gradvist skifter til en udvidet-rig tilstand efter tryk. Derefter, i ophidset tilstand (hυ), disse to konformere udsende -
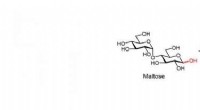 Den søde smag af succes for en understøttet nikkel -legeringskatalysator af nikkelphosphidKatalytisk hydrogenering af maltose til maltitol. Kredit:Osaka University Katalysatorer er kernen i en grønnere og mere bæredygtig fremtid for kemisk produktion. Imidlertid, mange af de katalysato
Den søde smag af succes for en understøttet nikkel -legeringskatalysator af nikkelphosphidKatalytisk hydrogenering af maltose til maltitol. Kredit:Osaka University Katalysatorer er kernen i en grønnere og mere bæredygtig fremtid for kemisk produktion. Imidlertid, mange af de katalysato -
 Biofornyelig proces kan hjælpe grøn plastKrystal af furandicarboxylsyre, eller FDCA, en plastikforløber skabt med biomasse i stedet for olie. Kredit:UW-Madison-billede af Ali Hussain Motagamwala og James Runde Da John Wesley Hyatt patent
Biofornyelig proces kan hjælpe grøn plastKrystal af furandicarboxylsyre, eller FDCA, en plastikforløber skabt med biomasse i stedet for olie. Kredit:UW-Madison-billede af Ali Hussain Motagamwala og James Runde Da John Wesley Hyatt patent
- Sådan bliver du hærens lufttrafikleder
- Efterligning af synapser i den menneskelige hjerne kan føre til smartere elektronik
- Hvorfor falder meteorer til jorden?
- Forskere udvikler et nyt værktøjssæt til handling inden for social retfærdighed
- Hvordan sporer kul tilbage til fotosyntesen?
- Science Fair Project Idéer på biler


