Hvorfor thallium har 1 oxidationstilstand og gallium 3 -tilstand?
thallium (tl)
* fælles oxidationstilstand: +1
* Anden oxidationstilstand: +3
gallium (ga)
* fælles oxidationstilstand: +3
* Anden oxidationstilstand: +1 og +2
Forklaring på deres almindelige oxidation siger:
* thallium: Thallium har et fyldt 5D -underskal og et enkelt elektron i sit 6P -underskal. Denne elektron fjernes relativt let, hvilket fører til +1 oxidationstilstand. +3 -tilstand involverer fjernelse af begge 6p -elektroner, hvilket kræver markant mere energi. Imidlertid kan thallium også udvise +3 oxidationstilstand i forbindelser som TLCL3 og TL (NO3) 3.
* gallium: Gallium har et fyldt 3D -underskal og tre elektroner i sin 4P -underskal. Disse 4p -elektroner fjernes relativt let, hvilket resulterer i +3 oxidationstilstand. Dette er den mest almindelige oxidationstilstand for gallium.
Faktorer, der påvirker oxidationstilstande:
* Elektronkonfiguration: Antallet og arrangementet af elektroner i et atom bestemmer dets potentielle oxidationstilstande.
* Elektronegativitet: Elektronegativitet påvirker, hvor let et atom får eller mister elektroner.
* reaktionsbetingelser: De specifikke reaktionsbetingelser (temperatur, tryk, reaktanter) kan påvirke et elements oxidationstilstand.
Sammenfattende kan både thallium og gallium udvise flere oxidationstilstande. +1 er imidlertid den mest almindelige oxidationstilstand for thallium, mens +3 er den mest almindelige for gallium.
Sidste artikelKan du i stedet bruge trisodiumcitrat af natrium 2 -hydrat?
Næste artikelHvad er ildfaste oxider?
 Varme artikler
Varme artikler
-
 Palladium, mød kobber:Forskere bruger maskinlæring til at forbedre katalysatorerKredit:Pixabay/CC0 Public Domain Forskere fra Skoltech og deres kolleger fra Tyskland og USA har undersøgt egenskaberne og opførselen af en palladium-kobberlegering under skiftende temperaturer
Palladium, mød kobber:Forskere bruger maskinlæring til at forbedre katalysatorerKredit:Pixabay/CC0 Public Domain Forskere fra Skoltech og deres kolleger fra Tyskland og USA har undersøgt egenskaberne og opførselen af en palladium-kobberlegering under skiftende temperaturer -
 Ny polymer frigiver molekylær last som reaktion på kraftKumarin farvestof, det kemikalie, der er valgt som den molekylære nyttelast i denne undersøgelse, fluorescerer, når de udsættes for ultraviolet lys. Kredit:Caltech Caltech-forskere har udviklet en
Ny polymer frigiver molekylær last som reaktion på kraftKumarin farvestof, det kemikalie, der er valgt som den molekylære nyttelast i denne undersøgelse, fluorescerer, når de udsættes for ultraviolet lys. Kredit:Caltech Caltech-forskere har udviklet en -
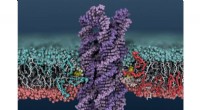 DNA -enzym blander cellemembraner tusind gange hurtigere end dets naturlige modstykkeEt syntetisk DNA -enzym indsættes i en cellemembran, får lipider til at blande sig mellem de indre og ydre membranlag. Kredit:Christopher Maffeo Et nyt syntetisk enzym, fremstillet af DNA frem for
DNA -enzym blander cellemembraner tusind gange hurtigere end dets naturlige modstykkeEt syntetisk DNA -enzym indsættes i en cellemembran, får lipider til at blande sig mellem de indre og ydre membranlag. Kredit:Christopher Maffeo Et nyt syntetisk enzym, fremstillet af DNA frem for -
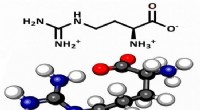 Forskere finder, at aminosyren arginin kan have spillet en vigtigere rolle i livets kemiske oprindel…Kredit:University of California - Santa Barbara Livet, som vi kender det, opstod for omkring 3,5 til 4 milliarder år siden i form af en præbiotisk (før livet) suppe af organiske molekyler, der på
Forskere finder, at aminosyren arginin kan have spillet en vigtigere rolle i livets kemiske oprindel…Kredit:University of California - Santa Barbara Livet, som vi kender det, opstod for omkring 3,5 til 4 milliarder år siden i form af en præbiotisk (før livet) suppe af organiske molekyler, der på
- Hvad er forholdet mellem et neutron til proton-forhold og dets stabilitet?
- Brænder magnesium bedre i nitrogen eller ilt?
- Grønt og sødt:Hvordan plantesukker påvirker malariatransmission
- Fysikere udvider kvantemaskinlæring til uendelige dimensioner
- Hvad ville forskere gøre, hvis de opdagede en organisme, der ikke kunne passe ind i nogen af de f…
- Børns mentale sundhed kan kæmpe under onlineskole. Sådan planlægger lærerne fremad.


