Hvad er svovlelektronkonfiguration?
1S² 2S² 2P⁶ 3S² 3P⁴
Her er en sammenbrud:
* 1S²: Det første energiniveau (n =1) har en underskal (er), der kan indeholde 2 elektroner.
* 2s²: Det andet energiniveau (n =2) har ens underskal, der kan indeholde 2 elektroner.
* 2p⁶: Det andet energiniveau (n =2) har også tre P -underskaller, der hver har 2 elektroner, i alt 6 elektroner.
* 3S²: Det tredje energiniveau (n =3) har ens underskal, der kan indeholde 2 elektroner.
* 3p⁴: Det tredje energiniveau (n =3) har tre P -underskaller, men kun 4 elektroner optager dem.
Vigtig note: Dette er jordtilstandens elektronkonfiguration. Det er muligt for svovl at have en ophidset tilstandskonfiguration, hvor elektroner midlertidigt fremmes til højere energiniveau.
Sidste artikelHvor mange gram CaCl2 er lige 3,40 mol CaCl2?
Næste artikelHvilken temp smelter krystaller i Fahrenheit?
 Varme artikler
Varme artikler
-
 Forskere udvikler holdbart materiale til fleksible kunstige musklerEn 4x5-tommer film lavet af 10 lag bearbejdelige, højtydende dielektriske elastomerer (PHDE) stablet sammen med 20 aktuatorer. Kredit:Soft Materials Research Lab/UCLA UCLA materialeforskere og koll
Forskere udvikler holdbart materiale til fleksible kunstige musklerEn 4x5-tommer film lavet af 10 lag bearbejdelige, højtydende dielektriske elastomerer (PHDE) stablet sammen med 20 aktuatorer. Kredit:Soft Materials Research Lab/UCLA UCLA materialeforskere og koll -
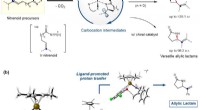 Ny katalytisk tilgang til adgang til nøglemellemkarbokation98%). (b) Beregningsmodellering til at bevise mellemvirkningen af carbocation og for at forstå det selektivitetsbestemmende trin. Kredit:IBS Den menneskelige civilisation i det 21. århundrede er
Ny katalytisk tilgang til adgang til nøglemellemkarbokation98%). (b) Beregningsmodellering til at bevise mellemvirkningen af carbocation og for at forstå det selektivitetsbestemmende trin. Kredit:IBS Den menneskelige civilisation i det 21. århundrede er -
 Forbedret forståelse af industrielle elektrodeprocesserElektroden, der bruges til målingerne, er kun en hundrededel i tykkelsen af et menneskehår. Kredit:RUB, Marquard I den industrielle produktion af klor, specielle elektroder er for nylig blevet i
Forbedret forståelse af industrielle elektrodeprocesserElektroden, der bruges til målingerne, er kun en hundrededel i tykkelsen af et menneskehår. Kredit:RUB, Marquard I den industrielle produktion af klor, specielle elektroder er for nylig blevet i -
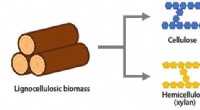 Ny metabolisk ingeniørstrategi forbedrer bioproduktion af polymerråmaterialerFigur 1:Strukturelle komponenter af lignocelluloseholdig biomasse (som ikke konkurrerer med globale fødevareforsyninger). Kredit:Kobe University En forskergruppe, bestående af doktorand Fujiwara R
Ny metabolisk ingeniørstrategi forbedrer bioproduktion af polymerråmaterialerFigur 1:Strukturelle komponenter af lignocelluloseholdig biomasse (som ikke konkurrerer med globale fødevareforsyninger). Kredit:Kobe University En forskergruppe, bestående af doktorand Fujiwara R
- Hvordan det menneskelige åndedrætssystem virker
- Hvorfor har du knogler og rødt blod færre mitokondrier?
- NASAs ICESat-2 forbereder sig til lasertests
- Ulighed er dårligt for samfundet, økonomisk velstand god
- Ny forskning kan kaste lys over, hvordan kuldioxidudslip fra det sydlige Ocean kan påvirke klimaæn…
- Enhed til et mål for modstand mod ændringsbevægelse?


