Hvor meget varme frigives, når 6,44 gram svovl reagerer med overskydende ilt?
1. Skriv den afbalancerede kemiske ligning:
Reaktionen af svovl med ilt producerer svovldioxid:
S (S) + O₂ (G) → SO₂ (G)
2. Bestem den molære masse af svovl:
Den molære masse af svovl (er) er 32,06 g/mol.
3. Beregn molen af svovl:
Mol svovl =(masse af svovl) / (molær masse svovl)
Mol svovl =6,44 g / 32,06 g / mol
Mol svovl ≈ 0,201 mol
4. Bestem entalpien ændring af reaktionen (ΔH):
Den standard enthalpi -ændring af dannelse (ΔHF °) for svovldioxid (SO₂) er -296,8 kJ/mol. Dette betyder, at 296,8 kJ varme frigøres, når der dannes en mol so₂.
5. Beregn den frigivne varme:
Da reaktionen frigiver varme, er enthalpiændringen negativ. Den frigivne varme er direkte proportional med molen af svovl, der reagerer.
Varme frigivet =(mol svovl) × (ΔH)
Varme frigivet =(0,201 mol) × (-296,8 kJ/mol)
Varme frigivet ≈ -59,7 kJ
Derfor frigives ca. 59,7 kJ varme, når 6,44 gram svovl reagerer med overskydende ilt.
 Varme artikler
Varme artikler
-
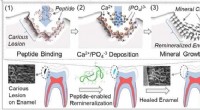 Peptidbaseret biogent tandprodukt kan helbrede hullerSkematisk illustration af peptidstyret biomimetisk tandreparationsteknologi. Kredit:ACS Publications Forskere ved University of Washington har designet et praktisk og naturligt produkt, der bruger
Peptidbaseret biogent tandprodukt kan helbrede hullerSkematisk illustration af peptidstyret biomimetisk tandreparationsteknologi. Kredit:ACS Publications Forskere ved University of Washington har designet et praktisk og naturligt produkt, der bruger -
 Dundee lab løser HOIL-1 mysterietKredit:CC0 Public Domain Den mystiske funktion af et nøgleprotein er blevet afsløret efter et gennembrud af University of Dundee-forskere. HOIL-1 er en komponent i Linear Ubiquitin Assembly Compl
Dundee lab løser HOIL-1 mysterietKredit:CC0 Public Domain Den mystiske funktion af et nøgleprotein er blevet afsløret efter et gennembrud af University of Dundee-forskere. HOIL-1 er en komponent i Linear Ubiquitin Assembly Compl -
 Database for steganalyse af retsmedicinsk bevisJennifer Newman (nederst til højre) leder indsatsen for at opbygge en fotodatabase til steganalyseforskning. Kredit:Christopher Gannon Der er intet påfaldende eller bemærkelsesværdigt ved de titus
Database for steganalyse af retsmedicinsk bevisJennifer Newman (nederst til højre) leder indsatsen for at opbygge en fotodatabase til steganalyseforskning. Kredit:Christopher Gannon Der er intet påfaldende eller bemærkelsesværdigt ved de titus -
 Gør som romerne:Kraftværksbeton styrker med tidenForskerne fandt aluminiumholdig tobermorit dannet inde i væggene på grund af reaktioner mellem mineraler i betonblandingen i nærværelse af vand og moderat høje temperaturer over en længere periode. Kr
Gør som romerne:Kraftværksbeton styrker med tidenForskerne fandt aluminiumholdig tobermorit dannet inde i væggene på grund af reaktioner mellem mineraler i betonblandingen i nærværelse af vand og moderat høje temperaturer over en længere periode. Kr
- Tre grunde til, at det er problematisk at spore studerendes atleters menstruationscyklus
- Tysk domstol standser forberedelse af byggepladsen til Tesla-fabrikken
- Hvordan planeterne er ens og forskellige?
- Hvordan finder vi ting i rummets mørke?
- Er glycolyse en anabolisk eller katabolisk reaktion?
- Hvor langt kredserer Jorden?


