Hvad er den kombinationskapacitet af fluor?
Dette betyder, at et fluoratom kan danne et Enkelt kovalent binding med et andet atom.
Her er hvorfor:
* Valenselektroner: Fluor har 7 valenselektroner (elektroner i dens yderste skal).
* octet regel: For at opnå stabilitet har atomer en tendens til at vinde, miste eller dele elektroner for at have 8 valenselektroner (oktetreglen).
* binding: Fluor behøver kun at vinde et elektron for at afslutte sin oktet. Det gør dette ved at danne en enkelt kovalent binding med et andet atom, der deler et elektron med det atom.
Eksempler:
* HF (hydrogenfluorid): Fluor deler en elektron med brint til dannelse af en enkelt kovalent binding.
* f2 (fluordas): To fluoratomer deler et elektron hver til dannelse af en enkelt kovalent binding.
 Varme artikler
Varme artikler
-
 Porøs væske rummer større molekylerForberedelse og reologi af bure 1-3. Kredit: Naturkemi (2020). DOI:10.1038/s41557-020-0419-2 Et internationalt team af kemikere har udviklet en metode til at skabe en ionisk væske, porøs, tetraed
Porøs væske rummer større molekylerForberedelse og reologi af bure 1-3. Kredit: Naturkemi (2020). DOI:10.1038/s41557-020-0419-2 Et internationalt team af kemikere har udviklet en metode til at skabe en ionisk væske, porøs, tetraed -
 Retsmedicinsk regnskab kan forudsige fremtidig fødevaresvindelForskere arbejder på metoder, der er hurtigere end laboratorietests for at afgøre, om der er blevet pillet ved mad. Kredit:Pixabay/ Hans, licenseret under CC0 Madsvindel, hvor forskellige fødevare
Retsmedicinsk regnskab kan forudsige fremtidig fødevaresvindelForskere arbejder på metoder, der er hurtigere end laboratorietests for at afgøre, om der er blevet pillet ved mad. Kredit:Pixabay/ Hans, licenseret under CC0 Madsvindel, hvor forskellige fødevare -
 Billig, ikke-giftig nanofluid kan være en game-changer for olieindvindingKredit:Unsplash/CC0 Public Domain Forskere fra University of Houston har påvist, at en billig og ikke-giftig nanofluid kan bruges til effektivt at genvinde selv tung olie med høj viskositet fra re
Billig, ikke-giftig nanofluid kan være en game-changer for olieindvindingKredit:Unsplash/CC0 Public Domain Forskere fra University of Houston har påvist, at en billig og ikke-giftig nanofluid kan bruges til effektivt at genvinde selv tung olie med høj viskositet fra re -
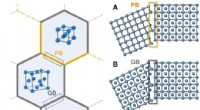 Brug af kemisk grænseteknik til at skabe stål, der er stærkt og fleksibelt uden højt kulstofindh…Skematisk illustration af en PB, en GB, og en CB. (A) PB, en grænse mellem to korn af forskellig gittertype. (B) GB, en grænse mellem to korn af samme gittertype, men med forskellige krystallografiske
Brug af kemisk grænseteknik til at skabe stål, der er stærkt og fleksibelt uden højt kulstofindh…Skematisk illustration af en PB, en GB, og en CB. (A) PB, en grænse mellem to korn af forskellig gittertype. (B) GB, en grænse mellem to korn af samme gittertype, men med forskellige krystallografiske
- Kina åbner en mega-bro, der forbinder Hong Kong med fastlandet
- Kan ulighed mellem kønnene dræbe? Papir ser på virkningen blandt ældre indiske kvinder
- Vil robotbiler køre trafikpropper ud for en klippe? (Opdatering)
- Hvad er et krav på videnskab?
- Hvad beskriver entropiændringen, når en opløsning laves fra væske til fast stof?
- Hvilken proces var umiddelbart forudgående proteinsyntese ved ribosomet?


