Hvad er handling af vand på metaller?
1. Korrosion:
* Oxidation: Dette er den primære måde, vand påvirker metaller på. Vand fungerer som en elektrolyt, der tillader ilt at reagere med metaloverfladen og danne metaloxider (rust i tilfælde af jern). Denne proces svækker metallet, hvilket gør det sprødt og tilbøjeligt til fiasko.
* Elektrokemisk korrosion: I nærvær af opløste salte og andre urenheder kan vand skabe en elektrokemisk celle på metaloverfladen. Dette fører til dannelsen af anodiske og katodiske steder, hvilket resulterer i accelereret korrosion.
* faktorer, der påvirker korrosion:
* Temperatur: Højere temperaturer fremskynder korrosion.
* ph: Aciditet eller alkalinitet af vandet kan påvirke korrosionshastigheden.
* opløst ilt: Højere iltindhold fremmer korrosion.
* opløste salte: Salt som chlorider kan øge korrosionshastigheder markant.
2. Kemiske reaktioner:
* reaktion med vand: Nogle metaller, såsom alkalimetaller (f.eks. Natrium, kalium), reagerer kraftigt med vand, der producerer brintgas og metalhydroxider. Denne reaktion kan være meget eksoterm, hvilket potentielt kan føre til eksplosioner.
* Dannelse af hydroxider: Nogle metaller, som aluminium, danner et beskyttende oxidlag, der forhindrer yderligere korrosion. I alkaliske miljøer kan oxidlaget imidlertid opløses og udsætte metallet for yderligere reaktion og potentielt danne metalhydroxider.
3. Fysiske effekter:
* erosion: Vand kan fysisk erodere metaloverflader, især når de flyder i høje hastigheder.
* stress korrosion revner: I nærvær af visse kemikalier kan vand forårsage revner til at udvikle sig i stressede metaller.
4. Metalspecifikke reaktioner:
* jern: Jernruster (danner jernoxider) i nærvær af ilt og vand. Rust er porøs og tillader yderligere korrosion at forekomme.
* aluminium: Aluminium danner et tyndt, beskyttende oxidlag, der forhindrer yderligere korrosion. Imidlertid kan dette lag kompromitteres i sure eller alkaliske miljøer.
* kobber: Kobber danner en grøn patina (kobbercarbonat) i nærvær af luft og vand. Denne patina er beskyttende og hjælper med at forhindre yderligere korrosion.
* guld og platin: Disse metaller er meget modstandsdygtige over for korrosion med vand og ilt på grund af deres inerte natur.
Beskyttelse af metaller mod vand:
* belægninger: Påføring af beskyttelsesbelægninger som maling, lakker eller metalbelægning kan skabe en barriere mellem metal og vand.
* legering: Blanding af metaller for at skabe legeringer kan forbedre deres modstand mod korrosion.
* katodisk beskyttelse: Brug af offeranoder (metaller korroderede lettere end det beskyttede metal) eller imponerer en elektrisk strøm for at forhindre korrosion.
* Vandbehandling: Fjernelse af opløst ilt, salte og andre ætsende stoffer fra vand kan reducere korrosionshastigheder markant.
Det er vigtigt at forstå de specifikke egenskaber for hvert metal og de betingelser, det vil blive udsat for for at implementere passende beskyttelsesforanstaltninger.
Sidste artikelHvad laver magnesium og klor?
Næste artikelHvad er ordet ligning for natrium og ilt?
 Varme artikler
Varme artikler
-
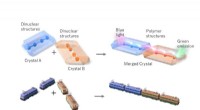 Linkede lanthanider skinner lys på krystalteknikNår blåt lys skinner på dysprosiumenden af forbundne lanthanidkrystaller (blå krystal), lyser terbiumenden (orange krystal) grønt. Dette sammenlignes med et tog, der transporterer energi. Kredit:Ped
Linkede lanthanider skinner lys på krystalteknikNår blåt lys skinner på dysprosiumenden af forbundne lanthanidkrystaller (blå krystal), lyser terbiumenden (orange krystal) grønt. Dette sammenlignes med et tog, der transporterer energi. Kredit:Ped -
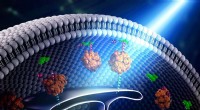 Bygger broer inden i cellen - ved hjælp af lysProteiner er byggestenene i broen mellem organeller i cellen. Kredit:Yun Huang og Yubin Zhou Hver celle i kroppen består af et antal små forseglede membranøse underenheder kaldet organeller, og de
Bygger broer inden i cellen - ved hjælp af lysProteiner er byggestenene i broen mellem organeller i cellen. Kredit:Yun Huang og Yubin Zhou Hver celle i kroppen består af et antal små forseglede membranøse underenheder kaldet organeller, og de -
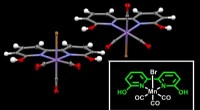 Rekruttering af mangan til at opgradere kuldioxidKrystalstruktur af den manganbaserede katalysator rapporteret i undersøgelsen. Manganatomet (i lilla) er i midten af rammen - liganden - hvilket letter hydrogeneringen af CO2. Kredit:Okinawa Insti
Rekruttering af mangan til at opgradere kuldioxidKrystalstruktur af den manganbaserede katalysator rapporteret i undersøgelsen. Manganatomet (i lilla) er i midten af rammen - liganden - hvilket letter hydrogeneringen af CO2. Kredit:Okinawa Insti -
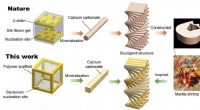 Kan bakterier gøre stærkere biler, fly og panser?Kredit:Qiming Wang, Usc Viterbi School of Engineering Biologiske systemer kan udnytte deres levende celler til vækst og regenerering, men det kan ingeniørsystemer ikke. Indtil nu. Qiming Wang og
Kan bakterier gøre stærkere biler, fly og panser?Kredit:Qiming Wang, Usc Viterbi School of Engineering Biologiske systemer kan udnytte deres levende celler til vækst og regenerering, men det kan ingeniørsystemer ikke. Indtil nu. Qiming Wang og
- Nøglekomponenter i Dark Energy Spectroscopic Instrument er installeret på toppen af Mayall-teles…
- Hvad er et efterskælv? Lær om de mindre jordskælv, der påvirker det nordlige Californien.
- Hvordan en mariehøne vrider rum-tid
- Kan der være en måned uden fuldmåne?
- Modulær tilgang til dibenzo-fusionerede ε-lactamer gennem carbene-brodannende CH-aktivering
- T-34 Medium Tank


