Maxium -mængde Cu2'er, der kan dannes, hvis 42,35G Ni2S3 reagerer med 66,01G Cuno3?
1. Skriv den afbalancerede kemiske ligning
Reaktionen mellem nikkel (III) sulfid (Ni₂s₃) og kobber (I) nitrat (Cuno₃) producerer kobber (I) sulfid (Cu₂s) og nikkel (II) nitrat (Ni (No₃) ₂). Her er den afbalancerede ligning:
Ni₂s₃ + 6 cuno₃ → 3 cu₂s + 2 ni (no₃) ₂ ₂
2. Beregn molen for hver reaktant
* mol ni₂s₃:
- Molmasse af ni₂s₃ =(2 * 58,69 g/mol ni) + (3 * 32,07 g/mol s) =214,47 g/mol
- Mol Ni₂s₃ =42,35 g / 214,47 g / mol =0,197 mol
* mol Cuno₃:
- Molmasse af cuno₃ =63,55 g/mol Cu + 14,01 g/mol n + 3 * 16,00 g/mol O =125,56 g/mol
- Mol Cuno₃ =66,01 g / 125,56 g / mol =0,525 mol
3. Bestem den begrænsende reaktant
Den begrænsende reaktant er den, der først bliver brugt op og begrænser mængden af produkt, der kan dannes. At finde dette:
* Sammenlign molforholdet mellem reaktanterne og det støkiometriske forhold i den afbalancerede ligning. Den afbalancerede ligning viser et forhold på 1:6 mol på Ni₂s₃ til Cuno₃.
* Beregn de krævede mol cuno₃ for at reagere fuldstændigt med de givne mol ni₂s₃:
- 0,197 mol ni₂s₃ * (6 mol cuno₃ / 1 mol ni₂s₃) =1,182 mol cuno₃
* Da vi kun har 0,525 mol cuno₃, er det den begrænsende reaktant.
4. Beregn det teoretiske udbytte af Cu₂s
* Brug molforholdet fra den afbalancerede ligning til at bestemme molen af Cu₂s dannet fra den begrænsende reaktant (Cuno₃):
- 0,525 mol cuno₃ * (3 mol Cu₂s / 6 mol cuno₃) =0,2625 mol cu₂s
* Konverter mol Cu₂s til gram:
- Molmasse Cu₂s =2 * 63,55 g/mol Cu + 32,07 g/mol S =159,17 g/mol
- Masse Cu₂s =0,2625 mol * 159,17 g/mol =41,77 g
Derfor er den maksimale mængde CU₂s, der kan dannes, 41,77 g.
Sidste artikelHvad får du, når du fordamper en kobbersulfatopløsning?
Næste artikelHvad er produktet af SO3 plus H2O?
 Varme artikler
Varme artikler
-
 Fokusering på iltreduktionsreaktionen i søgen efter mere effektive brintcellerKredit:Leiden University En ihærdig postdoc-forsker overtalte professor Marc Koper til at forske i iltreduktionsreaktionen. I Kopers øjne var der lidt interesse der. Men de opdagede straks en helt
Fokusering på iltreduktionsreaktionen i søgen efter mere effektive brintcellerKredit:Leiden University En ihærdig postdoc-forsker overtalte professor Marc Koper til at forske i iltreduktionsreaktionen. I Kopers øjne var der lidt interesse der. Men de opdagede straks en helt -
 En elektrolytdesignstrategi til fremstilling af divalente metalbatterierBatterielektrolytter, der anvender aminbaserede chelateringsmidler, der opløser divalente kationer, viste stabil og meget reversibel plettering/stripping af Mg-metal som illustreret ved scanningselekt
En elektrolytdesignstrategi til fremstilling af divalente metalbatterierBatterielektrolytter, der anvender aminbaserede chelateringsmidler, der opløser divalente kationer, viste stabil og meget reversibel plettering/stripping af Mg-metal som illustreret ved scanningselekt -
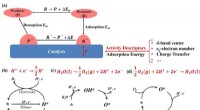 Aktivitetsbeskrivelser for elektrokatalysatorer i energilagringsapplikationer(a) Forskellige aktivitetsdeskriptorer for elektrokemiske reaktioner og katalytiske cyklusser af (b) hydrogenudviklingsreaktion, (c) oxygenudviklingsreaktion og (d) oxygenreduktionsreaktion i brændsel
Aktivitetsbeskrivelser for elektrokatalysatorer i energilagringsapplikationer(a) Forskellige aktivitetsdeskriptorer for elektrokemiske reaktioner og katalytiske cyklusser af (b) hydrogenudviklingsreaktion, (c) oxygenudviklingsreaktion og (d) oxygenreduktionsreaktion i brændsel -
 Teknikker til at observere beton, når det sætter sig, kan lette udviklingen af nye cementOlie- og naturgasboringer kræver beton for at forsegle området mellem brøndhylsteret og det omgivende borehul, men på grund af de høje temperaturer og tryk på dybden, det har været svært at studere, h
Teknikker til at observere beton, når det sætter sig, kan lette udviklingen af nye cementOlie- og naturgasboringer kræver beton for at forsegle området mellem brøndhylsteret og det omgivende borehul, men på grund af de høje temperaturer og tryk på dybden, det har været svært at studere, h
- Hvordan er præfikser nyttige inden for videnskab?
- Hvordan virker Weathering?
- Hvem forklarede, at evolution kunne have fundet sted i naturen fra enkel til kompleks form og oprind…
- Hvorfor troede Galileo, at solen drejede sig om jorden?
- Hvordan genvinder celler deres form efter at være blevet udsat for ydre kræfter?
- Sammenligning af mængden af energi, som to arter af Galapagos-skildpadder skal bruge for at vende…


