Hvilket volumen hydrogenchlorid produceres ved reaktionen 40 cm3 -klor med brint?
støkiometri og volumenforhold
* Kemisk ligning: Reaktionen af klor og brint er:
H₂ + cl₂ → 2HCl
* molforhold: Den afbalancerede ligning fortæller os, at 1 mol klor reagerer med 1 mol brint til at producere 2 mol brintchlorid.
* volumen og mol: Mængden af en gas er direkte proportional med antallet af mol (ved konstant temperatur og tryk). Dette er baseret på Avogadros lov.
Manglende information
For at beregne mængden af brintchlorid har du brug for:
1. volumen af brint: Du skal kende mængden af brint, der reagerer med klor.
2. Betingelser: Du skal kende temperaturen og trykket, hvorpå reaktionen forekommer. Dette giver dig mulighed for at konvertere mol til volumen ved hjælp af den ideelle gaslov.
eksempel
Lad os sige, at reaktionen er ved standardtemperatur og tryk (STP), hvor 1 mol af enhver gas optager 22,4 L.
* Hvis du reagerer 40 cm³ klor (som er 0,04 L) med et lige stort volumen brint (0,04 L), ville du producere:
* 0,04 L CL₂ X (2 mol HCI / 1 mol Cl₂) =0,08 mol HCI
* 0,08 mol HCl X (22,4 L / 1 mol HCI) =1,79 L HCI
Konklusion
Du har brug for mere information for at løse dette problem. Du har brug for mængden af brint og betingelserne (temperatur og tryk) for at beregne mængden af brintchloridproduceret.
 Varme artikler
Varme artikler
-
 Morgendagens datahukommelser:Brug af ny teknologi til at udforske enkeltmolekylemagneter i slowmotio…Lena Scherthan er den første forfatter til den aktuelle undersøgelse. Kredit:Koziel/TUK Ved lagring af data, konventionelle teknikker når i stigende grad deres grænser. Såkaldte enkeltmolekylemagn
Morgendagens datahukommelser:Brug af ny teknologi til at udforske enkeltmolekylemagneter i slowmotio…Lena Scherthan er den første forfatter til den aktuelle undersøgelse. Kredit:Koziel/TUK Ved lagring af data, konventionelle teknikker når i stigende grad deres grænser. Såkaldte enkeltmolekylemagn -
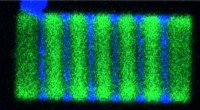 Ny klasse af bløde halvledere kunne transformere HD-skærmeEn 2-D plade, der viser skiftevis cæsium blychlorid (blå) og cæsium blybromid (grøn) segmenter. Kredit:Letian Dou/Berkeley Lab og Connor G. Bischak/UC Berkeley En ny type halvleder kan være på vej
Ny klasse af bløde halvledere kunne transformere HD-skærmeEn 2-D plade, der viser skiftevis cæsium blychlorid (blå) og cæsium blybromid (grøn) segmenter. Kredit:Letian Dou/Berkeley Lab og Connor G. Bischak/UC Berkeley En ny type halvleder kan være på vej -
 Ionledende polymer er afgørende for at forbedre neuromorfe enhederFotografi af en neuromorf enhed brugt i denne undersøgelse. Kredit:Shunsuke Yamamoto Neuromorf refererer til efterligning af adfærden hos hjernens neurale celler. Når man taler om neuromorfe compu
Ionledende polymer er afgørende for at forbedre neuromorfe enhederFotografi af en neuromorf enhed brugt i denne undersøgelse. Kredit:Shunsuke Yamamoto Neuromorf refererer til efterligning af adfærden hos hjernens neurale celler. Når man taler om neuromorfe compu -
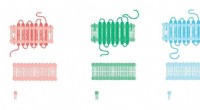 Struktur af den molekylære maskine, der forbinder kulhydrat- og lipidmetabolismeKredit:CC0 Public Domain Et forskerhold ledet af Dr. Kenneth Verstraete i Enheden for Strukturel Biologi ved VIB-UGent Center for Inflammationsforskning har afsløret den tredimensionelle struktur
Struktur af den molekylære maskine, der forbinder kulhydrat- og lipidmetabolismeKredit:CC0 Public Domain Et forskerhold ledet af Dr. Kenneth Verstraete i Enheden for Strukturel Biologi ved VIB-UGent Center for Inflammationsforskning har afsløret den tredimensionelle struktur
- Går Leo og Skorpionen sammen?
- Hvordan forskere analyserede de aerodynamiske egenskaber ved Tianwen-1 Mars faldskærm
- Hvordan adskiller du kobberpulver og salt?
- Hearing giver et kig på, hvad Uber står til at miste i Waymo-retssagen
- Hvad er den største træfødte frugt?
- Hawaii-teleskopet ser, hvad der kunne være den ældste galakse


