Ammoniumsulfat tilsat til et hydroxid?
Her er hvad der sker:
* ammoniumioner (NH₄⁺) reagerer med hydroxidioner (OH⁻) for at danne ammoniak (NH₃) og vand (H₂O):
NH₄⁺ + OH⁻ → NH₃ + H₂O
* sulfationer (so₄²⁻) forbliver i opløsning.
Den samlede reaktion kan repræsenteres som:
(NH₄) ₂SO₄ + 2OH⁻ → 2NH₃ + 2H₂O + SO₄²⁻
Vigtige punkter:
* Reaktionen er eksoterm, hvilket betyder, at den frigiver varme.
* produceret ammoniak er en svag base, så løsningen bliver lidt grundlæggende.
* Den anvendte hydroxid bestemmer de specifikke produkter og den samlede reaktion. For eksempel, hvis du bruger natriumhydroxid (NaOH), vil produkterne være natriumsulfat (Na₂so₄) og ammoniak.
Eksempler:
* ammoniumsulfat + kaliumhydroxid:
(NH₄) ₂SO₄ + 2KOH → 2NH₃ + 2H₂O + K₂SO₄
* ammoniumsulfat + calciumhydroxid:
(NH₄) ₂SO₄ + CA (OH) ₂ → 2NH₃ + 2H₂O + CASO₄
Bemærk: De specifikke produkter og reaktionsbetingelser kan variere afhængigt af koncentrationen af reaktanterne og tilstedeværelsen af andre ioner i opløsningen.
Sidste artikelHvorfor er deres mere ilt i vand nær overfladen?
Næste artikelHvor mange elektroniske skaller har nitrogen?
 Varme artikler
Varme artikler
-
 Ny symmetri-brydende metode åbner vej for bioaktive forbindelserEn demonstration af molekylær chiralitet ved hjælp af 3-D atommodeller i laboratoriet. Kredit:J. Waser/EPFL Mange kemiske molekyler kan eksistere i naturen sammen med deres spejlmodstykker; som hæ
Ny symmetri-brydende metode åbner vej for bioaktive forbindelserEn demonstration af molekylær chiralitet ved hjælp af 3-D atommodeller i laboratoriet. Kredit:J. Waser/EPFL Mange kemiske molekyler kan eksistere i naturen sammen med deres spejlmodstykker; som hæ -
 Proteinmolekyler i celler fungerer som miniatureantennerEn krystal af et rødt fluorescerende protein placeret i et kombineret instrument bestående af et fluorescensmikroskop og et røntgendiffraktometer. Krystallen lyser rødt, når den belyses af en blå lase
Proteinmolekyler i celler fungerer som miniatureantennerEn krystal af et rødt fluorescerende protein placeret i et kombineret instrument bestående af et fluorescensmikroskop og et røntgendiffraktometer. Krystallen lyser rødt, når den belyses af en blå lase -
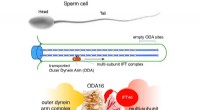 Transport af molekylære motorer til ciliaBilledet øverst viser en sædcelle med hoved (cellekrop) og hale (også kendt som flagellum eller cilium), der driver sædcellen fremad. Skemaet i midten viser, hvordan dyneinmotorer (gule stjerner) tran
Transport af molekylære motorer til ciliaBilledet øverst viser en sædcelle med hoved (cellekrop) og hale (også kendt som flagellum eller cilium), der driver sædcellen fremad. Skemaet i midten viser, hvordan dyneinmotorer (gule stjerner) tran -
 Varmevenlige mikrober giver en effektiv måde at bionedbryde plastik påSEM-analyse af PET-film under bionedbrydning ved anvendelse af C. thermocellum helcellebiokatalysator ved 60°C. Kredit:Liu Yajun Forskere i Kina har konstrueret en mikrobe, der viser lovende som g
Varmevenlige mikrober giver en effektiv måde at bionedbryde plastik påSEM-analyse af PET-film under bionedbrydning ved anvendelse af C. thermocellum helcellebiokatalysator ved 60°C. Kredit:Liu Yajun Forskere i Kina har konstrueret en mikrobe, der viser lovende som g
- Er det sandt første bevægelseslov siger, at et objekt i hvile har en tendens til at forblive, og a…
- Kan kviksølv forårsage en formørkelse på jorden?
- Vulkanaktiviteten stopper ved Hawaii-krateret, men der forventes flere udbrud
- Strukturen og funktionen af ribosomer i eukaryoter og prokaryoter
- Hvad kaldes de største landmasser og vandmasser?
- Vrag af skib bundet til Bermuda Triangle fundet ud for Florida


