Hvordan reagerer Potash -alun med natriumcarbonat?
Reaktionsligning:
2 Kal (SO₄) ₂ · 12H₂O + 3 Na₂co₃ → Al₂ (CO₃) ₃ (S) + 3 k₂so₄ + 6 na₂so₄ + 24 H₂O
Forklaring:
* Dobbeltfortrængning: De positivt ladede ioner (kationer) og negativt ladede ioner (anioner) af reaktanterne switchpartnere.
* bundfaldsdannelse: Aluminiumcarbonat (al₂ (co₃) ₃) er uopløseligt i vand, hvilket betyder, at det ikke opløses let. Dette får det til at danne et solidt bundfald, der sætter sig ud af opløsningen.
* Andre produkter: Kaliumsulfat (k₂so₄) og natriumsulfat (Na₂so₄) er opløselige i vand og forbliver opløst.
* Vand: Vandmolekylerne fra det hydratiserede alun og selve reaktionen er også til stede i opløsningen.
Kortfattet:
Når Potash -alun reagerer med natriumcarbonat, former et hvidt bundfald af aluminiumcarbonatformer sammen med opløseligt kaliumsulfat og natriumsulfat. Reaktionen er i det væsentlige en proces med at udveksle ioner mellem de to reaktanter, hvilket fører til dannelse af et fast produkt.
Sidste artikelHvor mange elektroner omgiver kernen i et atomkalium?
Næste artikelHvad er kogende og smeltepunkterne for alkalisk jordmetal?
 Varme artikler
Varme artikler
-
 Tænd og sluk for en porøs materialefarve med syreBillede af den skabte hydrogenbinding organiske ramme CPHATN- (TCB) (til venstre), og dens aktiverede version, CPHATN-1a (højre). Kredit:Hisaki I. et al., Syreresponsive, hydrogenbundne organiske ramm
Tænd og sluk for en porøs materialefarve med syreBillede af den skabte hydrogenbinding organiske ramme CPHATN- (TCB) (til venstre), og dens aktiverede version, CPHATN-1a (højre). Kredit:Hisaki I. et al., Syreresponsive, hydrogenbundne organiske ramm -
 Forskere registrerer greenlight gasdetektering ved stuetemperaturSkyder. Kredit:MIPT Russiske forskere har udviklet en mekanisme til at detektere molekylært brint ved hjælp af grønt lys til at belyse en nanokrystallinsk sammensat sensor baseret på zink og indiu
Forskere registrerer greenlight gasdetektering ved stuetemperaturSkyder. Kredit:MIPT Russiske forskere har udviklet en mekanisme til at detektere molekylært brint ved hjælp af grønt lys til at belyse en nanokrystallinsk sammensat sensor baseret på zink og indiu -
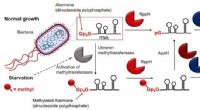 Opdagelse af helt ny klasse af RNA -hætter i bakterierGrafisk abstrakt. Kredit:Hudeček, O., Benoni, R., Reyes-Gutierrez, P.E. et al. Gruppen af Dr. Hana Cahová fra CAS, Institute of Organic Chemistry and Biochemistry, i samarbejde med forskere fra
Opdagelse af helt ny klasse af RNA -hætter i bakterierGrafisk abstrakt. Kredit:Hudeček, O., Benoni, R., Reyes-Gutierrez, P.E. et al. Gruppen af Dr. Hana Cahová fra CAS, Institute of Organic Chemistry and Biochemistry, i samarbejde med forskere fra -
 Forvandling af afgrødeaffald til modeprodukter af høj værdiKredit:Unsplash/CC0 Public Domain Forskere ved Cranfield University arbejder sammen med partnere ved University of York for at udvikle en grønnere måde at fremstille tekstiler til beklædning ved h
Forvandling af afgrødeaffald til modeprodukter af høj værdiKredit:Unsplash/CC0 Public Domain Forskere ved Cranfield University arbejder sammen med partnere ved University of York for at udvikle en grønnere måde at fremstille tekstiler til beklædning ved h
- En ansigtsfølgende robotarm med følelsesregistrering
- Hvornår sluttede American Apollo?
- Hvad er den arkæologiske metode?
- Nedbrydning af Beowulf:Statistisk teknik finder bevis på, at gammelengelsk digt havde en enkelt for…
- Facebooks administrerende direktør havde ikke alle svarene til Kongressen
- Nanoskala -søjler kan radikalt forbedre omdannelsen af varme til elektricitet


