Vil rubidiumchlorid opløses i vand?
* ionisk forbindelse: Rubidiumchlorid er en ionisk forbindelse, hvilket betyder, at det dannes af den elektrostatiske tiltrækning mellem en positivt ladet rubidiumion (RB+) og en negativt ladet chloridion (CL-).
* polært opløsningsmiddel: Vand er et polært opløsningsmiddel, hvilket betyder, at det har en delvis positiv ladning på den ene side af molekylet og en delvis negativ ladning på det andet.
* opløsningsproces: Når rubidiumchlorid tilsættes vand, omgiver vandmolekylerne ionerne. De positivt ladede brintender af vandmolekylerne tiltrækker chloridioner, mens de negativt ladede iltender tiltrækker rubidiumionerne. Denne interaktion svækker de ioniske bindinger i RBCL -krystalgitteret, hvilket får den til at opløses.
faktorer, der påvirker opløselighed:
* Temperatur: Opløselighed af de fleste ioniske forbindelser øges med temperaturen.
* Polaritet: RBCL er meget opløselig i polære opløsningsmidler som vand, men mindre opløseligt i ikke-polære opløsningsmidler som olie.
Fortæl mig, hvis du har andre spørgsmål!
Sidste artikelHvordan finder du ud af formelenheden i en forbindelse?
Næste artikelHvor mange mol svovltrioxid dannes fra 3 dioxid?
 Varme artikler
Varme artikler
-
 Bakterielle biofilm, forsvindEn kunstners repræsentation af bakterier (lilla) bliver kompromitteret af en organisk rammefilm i kitosan-metal. Kredit:Colorado State University/ Avancerede funktionelle materialer Efter nogle
Bakterielle biofilm, forsvindEn kunstners repræsentation af bakterier (lilla) bliver kompromitteret af en organisk rammefilm i kitosan-metal. Kredit:Colorado State University/ Avancerede funktionelle materialer Efter nogle -
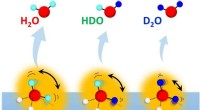 Indvirkningen af molekylær rotation på en ejendommelig isotopeffekt på vandhydrogenbindingerDesorption af vandisotopomerer (H 2 Åh, HDO og D 2 O) fra overflader af isotopblandet is med forskellige H/D-sammensætninger. Kredit:NINS/IMS Kvantenaturen af brintbindinger i vand manifeste
Indvirkningen af molekylær rotation på en ejendommelig isotopeffekt på vandhydrogenbindingerDesorption af vandisotopomerer (H 2 Åh, HDO og D 2 O) fra overflader af isotopblandet is med forskellige H/D-sammensætninger. Kredit:NINS/IMS Kvantenaturen af brintbindinger i vand manifeste -
 Sådan optimerer du processen med polymerekstruderingKredit:Pixabay/CC0 Public Domain Ekstrusion er en proces, der er meget udbredt i polymerforarbejdningsindustrien. Det involverer at skubbe materiale gennem en matrice med en bestemt tværsnitsform,
Sådan optimerer du processen med polymerekstruderingKredit:Pixabay/CC0 Public Domain Ekstrusion er en proces, der er meget udbredt i polymerforarbejdningsindustrien. Det involverer at skubbe materiale gennem en matrice med en bestemt tværsnitsform, -
 Infrarød sensor fungerer som et nyt værktøj til opdagelse af lægemidlerKredit:Sisacom, Shutterstock Forskere har fundet en ny metode til at analysere, hvordan aktive midler påvirker et specifikt protein, der er vigtigt for celleoverlevelse. Deres forskning kan hjælpe
Infrarød sensor fungerer som et nyt værktøj til opdagelse af lægemidlerKredit:Sisacom, Shutterstock Forskere har fundet en ny metode til at analysere, hvordan aktive midler påvirker et specifikt protein, der er vigtigt for celleoverlevelse. Deres forskning kan hjælpe
- Hvordan ændres solens højde i himlen gennem året?
- Dynamikken i seksuel chikane på arbejdspladsen i USA
- Optrævl nattehimlens mysterier med kunstig intelligens
- At ramme quantum sweet spot:Forskere finder den bedste position for atom qubits i silicium
- Opdeling af vand til prisen for et nikkel
- Astronom udgiver undersøgelse af unge stjerner


