Hvordan finder du ud af formelenheden i en forbindelse?
Forståelse af formelenheder
* Formelenhed: Den mindste elektrisk neutrale enhed, der repræsenterer sammensætningen af en ionisk forbindelse. Det er som "molekylet" for ioniske forbindelser.
* ioniske forbindelser: Dannet af den elektrostatiske tiltrækning mellem positivt ladede ioner (kationer) og negativt ladede ioner (ANION).
trin for at finde formelenheden
1. Identificer ionerne: Bestem kationen og anionen, der udgør forbindelsen. Du skal kende anklagerne for hver ion. Her er nogle nyttige ressourcer:
* Periodisk tabel: Den periodiske tabel giver gruppenumrene, som ofte angiver den typiske ladning for en ion for elementer i denne gruppe.
* fælles ionkort: Et diagram, der viser almindelige ioner og deres gebyrer.
2. afbalancere anklagerne: Den samlede opladning af formelenheden skal være nul. Dette opnås ved at bruge underskrifter til at indikere antallet af behov for hver ion.
* Eksempel: Natriumchlorid (NaCl):natrium (Na +) har en +1 ladning og chlorid (Cl-) har en -1 -ladning. En af hver ion er nødvendig for at afbalancere anklagerne.
3. Enkleste forhold: Underskrifterne i formelenheden repræsenterer det enkleste forhold mellem hele antal i ioner.
* Eksempel: Magnesiumchlorid (MGCL2):Magnesium (Mg2 +) har en +2 ladning, og chlorid (Cl-) har en -1 -ladning. To chloridioner (Cl-) er nødvendige for at afbalancere +2-ladningen af en magnesiumion (Mg2 +).
eksempel
Lad os finde formelenheden for calciumoxid:
1. Identificer ionerne: Calcium (Ca) danner en +2 ion (Ca2 +), og ilt (O) danner en -2 ion (O2-).
2. afbalancere anklagerne: Anklagerne er allerede afbalanceret, så vi har brug for en af hver ion.
3. Formelenhed: Formelenheden for calciumoxid er Cao.
vigtige noter
* romerske tal: Nogle overgangsmetaller danner flere ioner. Romertal i navnet angiver ladningen af metalionen (f.eks. Jern (II) oxid).
* polyatomiske ioner: Forbindelser kan omfatte polyatomiske ioner (grupper af atomer med nettoopladning). Behandl disse ioner som en enkelt enhed, når du afbalancerer gebyrer.
Lad mig vide, om du gerne vil øve med nogle specifikke eksempler!
Sidste artikelHvad er den molekylære sammensatte navn SF7?
Næste artikelVil rubidiumchlorid opløses i vand?
 Varme artikler
Varme artikler
-
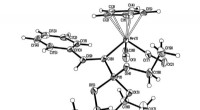 Kemikere opdager en ny dannelsesmekanisme for kræftbekæmpende stofferEt af cymantrenderivaterne, der blev brugt i undersøgelsen. Kredit:Alexander Smolyakov RUDN Universitets kemikere reviderede dannelsesmekanismen for organofosforkomplekser med metal. Resultaterne
Kemikere opdager en ny dannelsesmekanisme for kræftbekæmpende stofferEt af cymantrenderivaterne, der blev brugt i undersøgelsen. Kredit:Alexander Smolyakov RUDN Universitets kemikere reviderede dannelsesmekanismen for organofosforkomplekser med metal. Resultaterne -
 Genetisk årsag til ALS og frontotemporal demens blokeret af RNA-bindende forbindelseScripps Research Chemistry Professor Matthew Disney, Ph.d., går over en formel i sit laboratorium. Hans gruppe på Scripps Research i Jupiter, Florida har lavet et potentielt lægemiddel, der stopper AL
Genetisk årsag til ALS og frontotemporal demens blokeret af RNA-bindende forbindelseScripps Research Chemistry Professor Matthew Disney, Ph.d., går over en formel i sit laboratorium. Hans gruppe på Scripps Research i Jupiter, Florida har lavet et potentielt lægemiddel, der stopper AL -
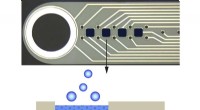 Ingen sukkerbelægning, men sød ikke desto mindreIngen sukkerbelægning. Kredit:Christian Böhler, Maria Asplund Komplekse neuroteknologiske anordninger er nødvendige for direkte at vælge og påvirke hjernebølger inde i kraniets indre. Selvom det e
Ingen sukkerbelægning, men sød ikke desto mindreIngen sukkerbelægning. Kredit:Christian Böhler, Maria Asplund Komplekse neuroteknologiske anordninger er nødvendige for direkte at vælge og påvirke hjernebølger inde i kraniets indre. Selvom det e -
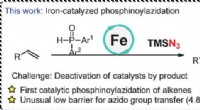 PcFe-katalyseret radikal phosphinoylazidering af alkener med et hurtigt azido-overførselstrinKredit:Dalian Institute of Chemical Physics, Det kinesiske akademis videnskaber Phosphinoylazidation af alkener er en direkte metode til at opbygge nitrogen- og fosforholdige forbindelser fra råst
PcFe-katalyseret radikal phosphinoylazidering af alkener med et hurtigt azido-overførselstrinKredit:Dalian Institute of Chemical Physics, Det kinesiske akademis videnskaber Phosphinoylazidation af alkener er en direkte metode til at opbygge nitrogen- og fosforholdige forbindelser fra råst
- Hvad er den ioniske forbindelse af BeCl2?
- Ammoniakens pH-niveau
- Hvor er en cellemembran i dyrecellen?
- Online bibliotek af egenskaber hjælper med at skabe sikrere nanomaterialer
- Hvad påvirker ikke dannelsen af magma?
- Hvad er den sfæriske region, der omgiver solsystemet og strækker sig næsten halvvejs til nærmest…


