Genetisk årsag til ALS og frontotemporal demens blokeret af RNA-bindende forbindelse

Scripps Research Chemistry Professor Matthew Disney, Ph.d., går over en formel i sit laboratorium. Hans gruppe på Scripps Research i Jupiter, Florida har lavet et potentielt lægemiddel, der stopper ALS, i tidlige studier. Kredit:Scripps Research
Siden isspand -udfordringen blev viral i 2014, øge bevidstheden og finansiering til ALS -forskning, forskere har lært meget om en sygdom, der afbryder muskler fra nerver, fører til muskelatrofi og eventuel død. Deres ultimative mål er at skabe medicin, der er i stand til at stoppe ALS i sine spor.
Skriver i journalen Cellekemisk biologi , Scripps Research -kemiker Matthew Disney, Ph.d., og kolleger beskriver en ny forbindelse, der blokerer den mest almindelige genetiske årsag til både familiær ALS og frontotemporal demens. Disneys gruppe vurderer sit potentiale for at blive et lægemiddel til behandling af begge disse sygdomme.
"Forhåbentlig, dette vil være en accelerator ikke kun for os, men for alle mennesker i felten, der arbejder hen imod en behandling for ALS, "Siger Disney.
Forbindelsen virker anderledes end de fleste lægemidler på markedet. I stedet for at binde sig til det giftige protein bag sygdommen, det binder sig til, hvad der er involveret i fremstilling af proteinet, en bestemt form for RNA foldet over som en hårnål. Da RNA -molekyler styrer ekspressionen af gener, intervenerer på RNA -niveau går lige til den tilsyneladende årsag til den form for sygdommen, Siger Disney.
"Der er nul terapier, der adresserer årsagen til denne sygdom, "Siger Disney." Nul. Vores mål er ikke at målrette symptomerne, det er at målrette den grundlæggende årsag, hvilket er det RNA. "
ALS, kort for amyotrofisk lateral sklerose, er også kendt som Lou Gehrigs sygdom til ære for den sene baseballlegende. Anslået 20, 000 mennesker i USA lever i øjeblikket med den neurodegenerative lidelse, herunder den tidligere professionelle fodboldspiller Tim Green, der for nylig meddelte sin sygdom på 60 minutter.
Der er sandsynligvis flere årsager til ALS. For anslået 1 ud af 10 personer med ALS, det kører i familien. Omkring en tredjedel af dem ser ud til at have arvet den type DNA -beskadigelse, som Disneys sammensætning retter sig mod.
Det beskadigede DNA ligger i en ikke-kodende sektion af det 9. kromosom. Der, en stammelignende gentagelse af bogstaverne GGGGCC beder cellens proteinbygningsmaskiner om at starte produktionen af et giftigt stof, C9RAN. Disney krediterer sin samarbejdspartner, Leonard Petrucelli fra Mayo Clinic i Jacksonville, FL, med co-opdagelse af årsagen. Det giftige stof ser ud til at forstyrre nervecellens normale stofskifte, fører til dens død, Siger Disney.
Det er døden af nerveforbindelserne mellem muskler og hjerne, der fører til ALS -symptomer på muskelatrofi, svaghed, synkebesvær og vejrtrækning. Ved frontotemporal demens, det giftige protein ser ud til at være en årsag til neurondød i dele af hjernen, der styrer adfærd og personlighed, frontal og temporal lapper. Disneys forbindelse, et lille molekyle, han designede, kaldes simpelthen "4, "i papiret. Det forstyrrer produktionen af det giftige C9RAN -protein, han siger.
Et vigtigt fund i papiret er, at formen for RNA, der målrettes af mange forskergrupper i øjeblikket, faktisk ikke er den, der driver neurondød, Siger Disney.
"Der er to forskellige former for proteinet. Dataene understøtter, at den form, folk ikke har set på, faktisk er den giftige, " han siger.
Mange spørgsmål skal besvares, før det er klart, at forbindelsen "4" kan tjene som et lægemiddel. Undersøgelsen er i gang, Tilføjer Disney.
"Vi har en lang og snoede vej til at gøre det til et lægemiddel. Du skal ikke kun vise, at et molekyle virker, men at det er sikkert, "siger han." Nu hvor vi har et mål, og vi ved, hvordan vi skal binde det, dette burde fremskynde fremstilling af forbindelser, der kunne blive medicin på en meget mere strømlinet måde. "
 Varme artikler
Varme artikler
-
 Afvisende forskning:Søværnet udvikler skibsbelægninger for at reducere brændstof, energiomkostni…Mathew Boban, en kandidatstuderende forskningsassistent ved University of Michigan, hælder hexadecanolie på et objektglas dækket med en omnifobisk belægning. De oliebaserede, meget viskøs olie glider
Afvisende forskning:Søværnet udvikler skibsbelægninger for at reducere brændstof, energiomkostni…Mathew Boban, en kandidatstuderende forskningsassistent ved University of Michigan, hælder hexadecanolie på et objektglas dækket med en omnifobisk belægning. De oliebaserede, meget viskøs olie glider -
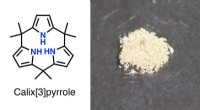 Pyrrolkemi:Gode ting kommer i treDen kemiske struktur og faststofkrystaller af calix[3]pyrrol. Kredit:Inokuma Laboratory En ny tilgang fører til den længe ventede dannelse af ringe lavet af tre pyrroler, som kunne bruges til at f
Pyrrolkemi:Gode ting kommer i treDen kemiske struktur og faststofkrystaller af calix[3]pyrrol. Kredit:Inokuma Laboratory En ny tilgang fører til den længe ventede dannelse af ringe lavet af tre pyrroler, som kunne bruges til at f -
 Sådan bestemmes hvilken forbindelse der er mere syrligEn simpel lakmustest kan fortælle dig, om en forbindelse er sur, basisk (alkalisk) eller neutral. Det er lidt mere udfordrende at finde ud af, hvor sur en forbindelse er i forhold til en anden. Du
Sådan bestemmes hvilken forbindelse der er mere syrligEn simpel lakmustest kan fortælle dig, om en forbindelse er sur, basisk (alkalisk) eller neutral. Det er lidt mere udfordrende at finde ud af, hvor sur en forbindelse er i forhold til en anden. Du -
 Ideel metode til hurtig sygdomstestningKredit:Pixabay I den pandemiske tidsalder med telesundhed og nye teknologier, remote site lab eller point-of-care (POC) test af biovæsker er en potentielt hurtig og ikke-invasiv måde at teste for
Ideel metode til hurtig sygdomstestningKredit:Pixabay I den pandemiske tidsalder med telesundhed og nye teknologier, remote site lab eller point-of-care (POC) test af biovæsker er en potentielt hurtig og ikke-invasiv måde at teste for


