Kaliummetal og klorgas kombineres for at danne kaliumchlorid?
* reaktanter: Kalium (K) og klor (CL₂)
* Produkt: Kaliumchlorid (KCL)
reaktionen:
2K (S) + Cl₂ (G) → 2KCl (S)
Denne reaktion er meget eksoterm, hvilket betyder, at den frigiver en masse varme og lys. Her er hvorfor:
* Metaller kan lide at miste elektroner: Kalium er et meget reaktivt metal, der er ivrig efter at miste sit ydre elektron for at blive en positivt ladet ion (K⁺).
* Ikke -metaller kan lide at få elektroner: Chlor er en ikke -metal, der ønsker at få et elektron for at blive en negativt ladet ion (CL⁻).
* ioniske obligationer form: Den stærke tiltrækning mellem de modsatte ladede ioner (K⁺ og CL⁻) skaber en stabil forbindelse, kaliumchlorid (KCL).
Sikkerhedsnotat: Denne reaktion er meget farlig, hvis den ikke håndteres korrekt. Det bør kun udføres af erfarne kemikere i et kontrolleret miljø.
Sidste artikelEr svovl en elementforbindelse eller blanding?
Næste artikelEr en isotop nitrogen en positiv ladning eller negativ ladning?
 Varme artikler
Varme artikler
-
 Falder i kø:Det enkle design og styring af MOF elektrisk flowAfhængigt af krystallernes orientering, den elektriske ledningsevne i parallel retning i dette billede er omkring 10 gange højere end i lodret retning. Kredit:M. Takahashi &K. Okada, Osaka Prefecture
Falder i kø:Det enkle design og styring af MOF elektrisk flowAfhængigt af krystallernes orientering, den elektriske ledningsevne i parallel retning i dette billede er omkring 10 gange højere end i lodret retning. Kredit:M. Takahashi &K. Okada, Osaka Prefecture -
 Forskning ser på materialets friktionsegenskaberSandia National Laboratories forskere Michael Chandross, venstre, og Nicolas Argibay viser en computersimulering og et ultrahøjt vakuum tribometer brugt til friktions- og slidtest, som er blandt de væ
Forskning ser på materialets friktionsegenskaberSandia National Laboratories forskere Michael Chandross, venstre, og Nicolas Argibay viser en computersimulering og et ultrahøjt vakuum tribometer brugt til friktions- og slidtest, som er blandt de væ -
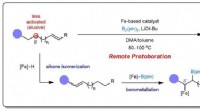 Bæredygtig jernkatalyse muliggør kontrollerbar alkenboryleringFigur 1:Skematisk viser designet af fjernprotoborering for at opnå selektiv borylering ved mindre aktiverede β-positioner. Kredit:National University of Singapore Kemikere fra National University
Bæredygtig jernkatalyse muliggør kontrollerbar alkenboryleringFigur 1:Skematisk viser designet af fjernprotoborering for at opnå selektiv borylering ved mindre aktiverede β-positioner. Kredit:National University of Singapore Kemikere fra National University -
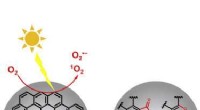 Partikelfasekemi gør det muligt for sod at spire skyer bedreMeget oxygenerede organiske molekyler med høj umættethed (HU-HOMer) dannes ved multigenerationel fotooxidation af store polycykliske aromatiske kulbrinter (PAHer) på sod. Kredit:Chem Meget oxygene
Partikelfasekemi gør det muligt for sod at spire skyer bedreMeget oxygenerede organiske molekyler med høj umættethed (HU-HOMer) dannes ved multigenerationel fotooxidation af store polycykliske aromatiske kulbrinter (PAHer) på sod. Kredit:Chem Meget oxygene
- Hvor mange ioner er der i ammoniumphosphat?
- Er relativ datering af den mest nøjagtige proces, hvorpå geologer bestemmer en klippealder?
- Hvorfor er en del af månen mørk?
- En guldalder i rumalderen? Vi kunne være minedrifts -asteroider inden 2018
- Er kaliumiodidopløsningsforbindelse eller blanding?
- Ordet, der beskriver, hvad er en strømkilde splitter atomer indeholder store mængder energi?


