Hvor meget natriumhydroxid skal tilsættes syreform en neutral opløsning?
* Identiteten og koncentrationen af syren: Forskellige syrer har forskellige styrker og kræver forskellige mængder NaOH for neutralisering.
* Mængden af syreopløsningen: Du skal vide, hvor meget syre du har at gøre med for at beregne den krævede mængde NaOH.
Her er, hvordan man nærmer sig problemet:
1. Bestem koncentrationen af syren: Dette gives typisk i enheder som mol pr. Liter (m) eller gram pr. Liter (g/l).
2. Bestem volumenet af syreopløsningen: Dette vil være i liter (L) eller ml (ML).
3. Beregn molen af syre: Multiplicer koncentrationen af syren med mængden af opløsningen.
4. Brug den afbalancerede kemiske ligning til at bestemme det støkiometriske forhold: Dette fortæller dig, at antallet af mol NaOH kræves for at neutralisere en mol syren. For eksempel er reaktionen mellem HCL og NaOH:
`` `
HCL + NaOH → NaCl + H₂O
`` `
I dette tilfælde reagerer en mol HCI med en mol NaOH.
5. Beregn molen af NaOH krævet: Multiplicer molen af syre med det støkiometriske forhold fra den afbalancerede ligning.
6. Konverter mol NaOH til gram: Brug den molære masse af NaOH (40 g/mol) til at konvertere mol NaOH til gram.
Eksempel:
Lad os sige, at du har 50 ml 0,1 M HCI -opløsning.
1. Koncentration af syre: 0,1 m
2. volumen af syre: 50 ml =0,05 l
3. mol syre: 0,1 m * 0,05 L =0,005 mol HCl
4. støkiometrisk forhold: 1 mol HCI:1 mol NaOH
5. mol NaOH: 0,005 mol HCI * (1 mol NaOH / 1 mol HCI) =0,005 mol NaOH
6. gram NaOH: 0,005 mol NaOH * 40 g/mol =0,2 g NaOH
Derfor bliver du nødt til at tilføje 0,2 gram natriumhydroxid At neutralisere 50 ml 0,1 M HCI -opløsning.
Vigtig note: Tilsæt altid basen (NaOH) langsomt til syren, under konstant omrøring, for at undgå en hurtig reaktion og potentiel varmeopbygning.
 Varme artikler
Varme artikler
-
 En sjælden bedrift:Materiale beskytter mod både biologiske og kemiske truslerProgrammerbar krystallinsk svamp-tekstil komposit til eliminering af biologiske og kemiske trusler. Kredit:Northwestern University Et forskningshold fra Northwestern University har udviklet et als
En sjælden bedrift:Materiale beskytter mod både biologiske og kemiske truslerProgrammerbar krystallinsk svamp-tekstil komposit til eliminering af biologiske og kemiske trusler. Kredit:Northwestern University Et forskningshold fra Northwestern University har udviklet et als -
 En demonstration af billeddannelse i det virkelige rum af nogle af de mest repræsentative former fo…Den skematiske model af solvatiserede protoner i enkeltlagsvand. Blå:solvatiserede protoner af Zundel-typen; Rød:vandmolekyler; Gul:guld substrat. Kredit:Ying Jiang, Peking University Et team af fo
En demonstration af billeddannelse i det virkelige rum af nogle af de mest repræsentative former fo…Den skematiske model af solvatiserede protoner i enkeltlagsvand. Blå:solvatiserede protoner af Zundel-typen; Rød:vandmolekyler; Gul:guld substrat. Kredit:Ying Jiang, Peking University Et team af fo -
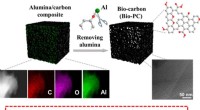 Grænseflade-induceret fremstilling af porøst kulstof med forbedrede iboende aktive stederUnder ikke-oxidationsbetingelser blev in-situ dannet aluminiumoxid/carbon-grænseflade udviklet som en vugge til generering af tilgængelige aktive steder. Det kan også justere den porøse struktur af re
Grænseflade-induceret fremstilling af porøst kulstof med forbedrede iboende aktive stederUnder ikke-oxidationsbetingelser blev in-situ dannet aluminiumoxid/carbon-grænseflade udviklet som en vugge til generering af tilgængelige aktive steder. Det kan også justere den porøse struktur af re -
 Drysset med kraft:Hvordan urenheder forstærker et termoelektrisk materiale på atomniveauHAXPES på Spring-8. Kredit:Dr Kotsugi I søgen efter løsninger på stadigt forværrede miljøproblemer, såsom udtømning af fossile brændstoffer og klimaændringer, mange har vendt sig til termoelektris
Drysset med kraft:Hvordan urenheder forstærker et termoelektrisk materiale på atomniveauHAXPES på Spring-8. Kredit:Dr Kotsugi I søgen efter løsninger på stadigt forværrede miljøproblemer, såsom udtømning af fossile brændstoffer og klimaændringer, mange har vendt sig til termoelektris
- Hvilke ting findes i atmosfæren?
- Hvilke egenskaber påvirker styrken af gravitationskraft mellem 2 objekter?
- Hvad er 3 delsystemer, der udgør det teknologiske system i en bil?
- FN disker op med figenkaktus som svar på fødevaresikkerhed
- En mulig ny måde at køle computerchips på
- Hvorfor er bjerge konstruktive?


