Hvorfor danner adelsgasser ikke obligationer med andre elementer?
* Elektronkonfiguration: Noble gasser har en fuld yderste elektronskal (også kaldet Valence Shell). Dette betyder, at de har det maksimale antal elektroner, som deres yderste energiniveau kan have. Denne konfiguration gør dem ekstremt stabile og ureaktive.
* octet regel: Octet -reglen siger, at atomer har en tendens til at vinde, miste eller dele elektroner for at opnå en stabil konfiguration med otte elektroner i deres yderste skal. Noble gasser har allerede otte valenselektroner, så de behøver ikke at vinde, miste eller dele elektroner for at opnå stabilitet.
* Høj ioniseringsenergi: Ædle gasser har meget høje ioniseringsenergier, hvilket betyder, at det kræver en masse energi at fjerne et elektron fra deres atomer. Dette gør det meget vanskeligt at danne positive ioner, som er nødvendige for ionisk binding.
* Lav elektronaffinitet: Ædle gasser har lave elektronaffiniteter, hvilket betyder, at de ikke let får elektroner. Dette gør det vanskeligt for dem at danne negative ioner, som er nødvendige for ionisk binding.
Undtagelser:
Mens ædle gasser generelt er ureaktive, er der nogle få undtagelser:
* xenon: Xenon kan danne forbindelser med stærkt elektronegative elementer som fluor og ilt (f.eks. XEF2, XEO2). Dette skyldes, at den store størrelse af xenon tillader, at dens ydre elektroner lettere påvirkes af andre elementer.
* radon: I lighed med Xenon kan radon også danne forbindelser, men på grund af dens radioaktivitet er den mindre undersøgt.
Sammenfattende er den stabile elektronkonfiguration af ædelgasser den primære årsag til, at de er ureaktive. De har en fuld yderste skal, hvilket gør dem meget stabile og modstandsdygtige over for dannelse af bindinger med andre elementer.
 Varme artikler
Varme artikler
-
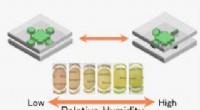 Funktionsfilm lavet af miljøvenlige lermineraler og farvestofferGennemsigtig hybridfilm sammensat af miljøvenlige lermineraler og farvestoffer, der ændrer farve med fugtighed via en ny mekanisme. Kredit:Shinsuke Takagi Forskere fra Tokyo Metropolitan Universit
Funktionsfilm lavet af miljøvenlige lermineraler og farvestofferGennemsigtig hybridfilm sammensat af miljøvenlige lermineraler og farvestoffer, der ændrer farve med fugtighed via en ny mekanisme. Kredit:Shinsuke Takagi Forskere fra Tokyo Metropolitan Universit -
 Avanceret fingeraftryksteknologi kan hjælpe i kampen mod knivkriminalitetKredit:CC0 Public Domain En ny fingeraftryksteknik, der er i stand til at producere billeder i høj opløsning fra de mest udfordrende metaloverflader, inklusive knive og skydevåben - tiltrækker all
Avanceret fingeraftryksteknologi kan hjælpe i kampen mod knivkriminalitetKredit:CC0 Public Domain En ny fingeraftryksteknik, der er i stand til at producere billeder i høj opløsning fra de mest udfordrende metaloverflader, inklusive knive og skydevåben - tiltrækker all -
 Forskning ser på materialets friktionsegenskaberSandia National Laboratories forskere Michael Chandross, venstre, og Nicolas Argibay viser en computersimulering og et ultrahøjt vakuum tribometer brugt til friktions- og slidtest, som er blandt de væ
Forskning ser på materialets friktionsegenskaberSandia National Laboratories forskere Michael Chandross, venstre, og Nicolas Argibay viser en computersimulering og et ultrahøjt vakuum tribometer brugt til friktions- og slidtest, som er blandt de væ -
 Innovative transistorer baseret på magnetisk induceret bevægelse af ionerKredit:National Institute for Materials Science Ligesom magneter tiltrækker jernpartikler i sandkasser, permanent magnetik tiltrækker kun én type ion i en elektrokemisk opløsning, udgør grundlaget
Innovative transistorer baseret på magnetisk induceret bevægelse af ionerKredit:National Institute for Materials Science Ligesom magneter tiltrækker jernpartikler i sandkasser, permanent magnetik tiltrækker kun én type ion i en elektrokemisk opløsning, udgør grundlaget
- OS, Storbritannien advarer om, at hackere i stigende grad bruger koronavirus lokkemad
- Orkan Firenze kunne bringe 40 tommer regn til Carolina-kysterne
- Er Saturn den 7 panet fra solen?
- Udvikling af køresimuleringer, der ser mere naturtro ud
- Værktøjer bruges til at skære diamanter
- Peak P? Fosfor, fødevareforsyning ansporer Southwest initiativ


