Hvilket element indeholder atomer, der danner farvede ioner og har mere end en positiv oxidationstilstand?
Her er hvorfor:
* farvede ioner: Overgangsmetaller har delvist fyldt D -orbitaler. Når disse orbitaler absorberer specifikke bølgelængder af lys og genemiterer andre, opfatter vi dette som farve.
* Flere oxidationstilstande: Overgangsmetaller kan miste forskellige antal elektroner fra deres D -orbitaler, hvilket resulterer i flere positive oxidationstilstande. Denne evne til at ændre oxidationstilstand er det, der giver dem mulighed for at danne en række farvede forbindelser og ioner.
Eksempler:
* kobber: Kan have +1 og +2 oxidationstilstande, danner blå Cu (I) -ioner og grønne Cu (II) -ioner.
* jern: Kan have +2 og +3 oxidationstilstande, danner lysegrønne Fe (II) -ioner og gulbrun Fe (III) ioner.
* mangan: Kan have +2, +3, +4, +6 og +7 oxidationstilstande, hver med forskellige farver.
Fortæl mig, hvis du gerne vil udforske specifikke overgangsmetaller og deres forbindelser!
 Varme artikler
Varme artikler
-
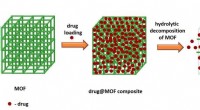 Bare tilsæt vand:Kemikere foreslår en løsning for uopløselige lægemidlerPå billedet er en skematisk repræsentation af et lægemiddel indkapslet i MOF, efterfulgt af den øjeblikkelige frigivelse af lægemidlet fra dets sammensætning. Kredit:Adam Matzger og Suresh Kuruthu
Bare tilsæt vand:Kemikere foreslår en løsning for uopløselige lægemidlerPå billedet er en skematisk repræsentation af et lægemiddel indkapslet i MOF, efterfulgt af den øjeblikkelige frigivelse af lægemidlet fra dets sammensætning. Kredit:Adam Matzger og Suresh Kuruthu -
 Gulerodscement:Hvordan rodfrugter og aske kunne gøre beton mere bæredygtigBeton er ansvarlig for 8% af de globale drivhusgasemissioner og er det næstmest anvendte stof i verden. Kredit:Harry Dona/Unsplash Beton er blevet vores foretrukne byggemateriale til utallige kons
Gulerodscement:Hvordan rodfrugter og aske kunne gøre beton mere bæredygtigBeton er ansvarlig for 8% af de globale drivhusgasemissioner og er det næstmest anvendte stof i verden. Kredit:Harry Dona/Unsplash Beton er blevet vores foretrukne byggemateriale til utallige kons -
 Dybt dyk ned i vigtige COVID-19-proteiner er et skridt mod nye lægemidler, vaccinerNukleocapsid-phosphoproteinet (blåt) af SARS-CoV-2 (N) (grå) spiller kritiske roller i flere processer i SARS-CoV-2-infektionscyklussen, inklusive replikation og transskription, og pakning og beskytte
Dybt dyk ned i vigtige COVID-19-proteiner er et skridt mod nye lægemidler, vaccinerNukleocapsid-phosphoproteinet (blåt) af SARS-CoV-2 (N) (grå) spiller kritiske roller i flere processer i SARS-CoV-2-infektionscyklussen, inklusive replikation og transskription, og pakning og beskytte -
 Adsorberende materiale filtrerer giftigt krom, arsen fra vandforsyningerForskere ved Oak Ridge National Laboratory designet et adsorberende materiale til hurtigt at fjerne giftigt krom og arsen på samme tid fra vandressourcer. Kredit:Adam Malin/ORNL, U.S. Dept. of Energy
Adsorberende materiale filtrerer giftigt krom, arsen fra vandforsyningerForskere ved Oak Ridge National Laboratory designet et adsorberende materiale til hurtigt at fjerne giftigt krom og arsen på samme tid fra vandressourcer. Kredit:Adam Malin/ORNL, U.S. Dept. of Energy
- Computermodeller finder ældgamle løsninger på moderne problemer
- Østrigerne til at drive stålindustrien udelukkende på ren brint
- Lærende kemiske netværk giver livet et chiralt twist
- Hvad tænkte han på? Studiet går over til abe-intellekt
- Havningeniører har brug for vejledning, der inkorporerer stigning i havniveau i konstruktionsdesign
- Udråbt som udvikling, jordfangster skader lokalsamfund, og kvinder mest af alt


