Dybt dyk ned i vigtige COVID-19-proteiner er et skridt mod nye lægemidler, vacciner
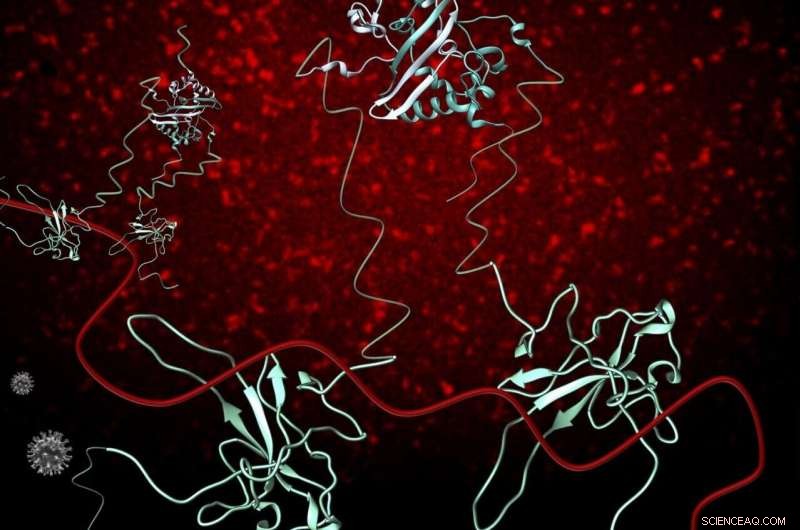
Nukleocapsid-phosphoproteinet (blåt) af SARS-CoV-2 (N) (grå) spiller kritiske roller i flere processer i SARS-CoV-2-infektionscyklussen, inklusive replikation og transskription, og pakning og beskyttelse af det genomiske RNA (gRNA) (rødt). N-proteinet eksisterer som en dimer i opløsning og interagerer med gRNA overvejende gennem dets strukturerede N-terminale domæne. N binder RNA multivalent, og efterhånden som flere N-proteiner bliver tilgængelige, stabiliserende interaktioner mellem RNA og proteiner forekommer, resulterer i et organiseret nukleocapsid. Fluorescensbilleddannelse af 1-1000 RNA med et Cy3 fluorescerende tag viser, at RNA-Cy3 med tilsætning af FL-N, bliver organiseret og fortættet (rød puncta baggrund). Kredit:OSU College of Science
Forskere ved Oregon State University College of Science har taget et vigtigt skridt mod nye lægemidler og vacciner til bekæmpelse af COVID-19 med et dybt dyk ned i ét proteins interaktioner med SARS-CoV-2 genetisk materiale.
Virusets nukleocapsidprotein, eller N-protein, er et primært mål for sygdomsbekæmpende interventioner på grund af de kritiske job, den udfører for den nye coronavirus-infektionscyklus, og fordi den muterer i et forholdsvis langsomt tempo. Lægemidler og vacciner bygget op omkring arbejdet med N-proteinet har potentialet til at være yderst effektive og i længere perioder – dvs. mindre modtagelig for modstand.
Blandt SARS-CoV-2-proteinerne, N-proteinet er det virale RNA's største partner. RNA'et har de genetiske instruktioner, som virussen bruger til at få levende celler, såsom menneskelige celler, at gøre mere ud af sig selv, og N-proteinet binder til RNA'et og beskytter det.
Udgivet i Biofysisk tidsskrift , resultaterne er et vigtigt springpunkt for yderligere undersøgelser af N-proteinet og dets interaktioner med RNA som en del af et grundigt kig på mekanismerne for SARS-CoV-2-infektion, transmission og kontrol.
Elisar Barbar, professor i biokemi og biofysik ved Oregon State, og ph.d. kandidat Heather Masson-Forsythe ledede undersøgelsen med hjælp fra bachelorstuderende Joaquin Rodriguez og Seth Pinckney. Forskerne brugte en række biofysiske teknikker, der måler ændringer i størrelsen og formen af N-proteinet, når det er bundet til et fragment af genomisk RNA-1, 000 nukleotider af de 30, 000-nukleotid genom.
"Genomet er ret stort for en virus og kræver mange kopier af N-proteinet for at klæbe til RNA'et for at give virussen den sfæriske form, som er nødvendig for, at virussen kan lave flere kopier af sig selv, " sagde Barbar. "Vores undersøgelse hjælper os med at kvantificere, hvor mange kopier af N er nødvendige, og hvor tæt de er på hinanden, når de holder sig til RNA'et. "
Biofysiske undersøgelser af N med store segmenter af RNA ved kernemagnetisk resonans er sjældne, Barbar sagde, på grund af vanskeligheden ved at fremstille det delvist uordnede N-protein og lange RNA-segmenter, både tilbøjelige til aggregering og nedbrydning, men den slags undersøgelser er en specialitet i Barbar-laboratoriet. Andre forskeres undersøgelser har generelt været begrænset til meget mindre stykker RNA og mindre stykker af N-proteinet.
I stedet for blot at se på de RNA-bindende områder af N-proteinet alene, den 1, 000-nukleotidvisning gjorde det muligt for videnskabsmænd at erfare, at proteinet binder meget stærkere, når det er en dimer i fuld længde - to kopier knyttet til hinanden - og at identificere områder af proteinet, der er essentielle for RNA-binding.
"Det fulde protein har strukturerede dele, men er faktisk virkelig fleksibelt, så vi ved, at denne fleksibilitet er vigtig for RNA-binding, " sagde Masson-Forsythe. "Vi ved også, at når N-proteiner begynder at binde sig til det længere RNA, resultatet er en mangfoldig samling af bundne protein/RNA-komplekser i modsætning til én måde at binde på."
Lægemidler, der forpurrer N-proteinets fleksibilitet, ville således være en potentiel vej for farmaceutiske forskere, hun sagde. En anden mulighed ville være lægemidler, der forstyrrer et hvilket som helst af de protein/RNA-komplekser, der viser sig at være af særlig betydning.
 Varme artikler
Varme artikler
-
 At bryde grænsen for kemiske forbindelserKredit:CC0 Public Domain Siden slutningen af det 19. århundrede, overgangsmetalcarbonyler har været en vigtig og velkendt klasse af forbindelser inden for koordinationskemi og organometallisk ke
At bryde grænsen for kemiske forbindelserKredit:CC0 Public Domain Siden slutningen af det 19. århundrede, overgangsmetalcarbonyler har været en vigtig og velkendt klasse af forbindelser inden for koordinationskemi og organometallisk ke -
 De udvidede muligheder for biobaserede polymererKredit:Institut for Kemisk Forskning i Catalonien At finde innovative og bæredygtige løsninger til vores materialebehov er et af kernemålene for grøn kemi. De utallige plastik, der omslutter vores
De udvidede muligheder for biobaserede polymererKredit:Institut for Kemisk Forskning i Catalonien At finde innovative og bæredygtige løsninger til vores materialebehov er et af kernemålene for grøn kemi. De utallige plastik, der omslutter vores -
 Hvorfor påvirker sukker frysepunktet?Vand fryser ved 32 grader Fahrenheit (0 grader Celsius), men når der tilsættes et opløsningsmiddel som sukker, ændres frysepunktet. Sukkermolekylerne forhindrer vandet i at fremstille brintbindinge
Hvorfor påvirker sukker frysepunktet?Vand fryser ved 32 grader Fahrenheit (0 grader Celsius), men når der tilsættes et opløsningsmiddel som sukker, ændres frysepunktet. Sukkermolekylerne forhindrer vandet i at fremstille brintbindinge -
 Ny forskning analyserer modelleringsteknikker for kulstoffangstteknologiKredit:CC0 Public Domain I overgangen til ren, vedvarende energi, der vil stadig være behov for konventionelle strømkilder, som kul og naturgas, for at sikre konstant strøm til nettet. Forskere ov
Ny forskning analyserer modelleringsteknikker for kulstoffangstteknologiKredit:CC0 Public Domain I overgangen til ren, vedvarende energi, der vil stadig være behov for konventionelle strømkilder, som kul og naturgas, for at sikre konstant strøm til nettet. Forskere ov
- Software genererer automatisk strikkeinstruktioner til 3D-former
- Hvordan bliver klimaet, når Jordens næste superkontinent dannes?
- Anklagere omfavner en farveblind tilgang til retsforfølgning, fremhæver behovet for kulturel omskr…
- Ford fejrer et århundrede med produktion på den berømte Rouge-fabrik
- Det første additivt fremstillede termiske beskyttelsesskjold skal ud i rummet
- Rumvandrende astronauter afslutter batteriforbedringer (Opdatering)


