Hvordan vil du retfærdiggøre, at salte er neutrale forbindelser?
1. Definitionen af "neutral"
* ph -skala: I kemi henviser "neutral" typisk til en pH-værdi på 7. Dette indikerer en balance mellem brint (H+) og hydroxid (OH-) -ioner.
* saltdannelse: Salte dannes fra reaktionen af en syre og en base, hvor syren donerer en hydrogenion (H+) og basen accepterer den.
2. Hvorfor nogle salte er neutrale:
* stærk syre + stærk base: Salte dannet fra reaktionen af en stærk syre (f.eks. HCI) og en stærk base (f.eks. NaOH) vil være neutral. Den stærke syre donerer sine H+ -ioner fuldstændigt, og den stærke base accepterer dem fuldstændigt, hvilket ikke overlader nogen overskydende ioner for at påvirke pH. For eksempel dannes NaCl (bordsalt) af HCL og NaOH, og det har en neutral pH.
3. Hvorfor nogle salte ikke er neutrale:
* svag syre + stærk base: Salte dannet fra reaktionen af en svag syre (f.eks. Eddikesyre) og en stærk base vil være lidt grundlæggende. Den svage syre donerer ikke fuldstændigt sine H+ -ioner, hvilket efterlader nogle i opløsning, hvilket fører til en højere pH. For eksempel er natriumacetat (NACH3COO) lidt grundlæggende.
* stærk syre + svag base: Salte dannet fra reaktionen af en stærk syre og en svag base vil være lidt sur. Den svage base accepterer ikke fuldt ud alle H+ -ioner, hvilket efterlader nogle i opløsning, hvilket fører til en lavere pH. For eksempel er ammoniumchlorid (NH4CL) let surt.
4. Konklusion:
* ikke alle salte er neutrale. Deres pH afhænger af styrken af den syre og base, der dannede dem.
* Mange almindelige salte er neutrale , især dem, der er dannet af stærke syrer og stærke baser.
For at retfærdiggøre en salts neutralitet er vi nødt til at overveje styrken af den syre og base, der producerede den.
 Varme artikler
Varme artikler
-
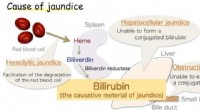 Forskere får gennembrud i antioxidantenzym forbundet med gulsotFig.1:Årsag til gulsot. Bilirubin er det forårsagende materiale til gulsot. Kredit:Osaka University Et japansk forskerhold involveret Osaka University undersøgte biliverdin reduktase, enzymet, der
Forskere får gennembrud i antioxidantenzym forbundet med gulsotFig.1:Årsag til gulsot. Bilirubin er det forårsagende materiale til gulsot. Kredit:Osaka University Et japansk forskerhold involveret Osaka University undersøgte biliverdin reduktase, enzymet, der -
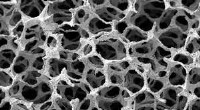 Metallisk skum kan opsuge lyd under højt tryk, miljøer med høje temperaturer såsom jetmotorerEt scanningselektronmikrofotografi af det nikkelbaserede superlegering med åbne celler. Kredit:Singapore Institute of Manufacturing Technology Superlegeringsskum kunne gøre skibs- og flymotorer me
Metallisk skum kan opsuge lyd under højt tryk, miljøer med høje temperaturer såsom jetmotorerEt scanningselektronmikrofotografi af det nikkelbaserede superlegering med åbne celler. Kredit:Singapore Institute of Manufacturing Technology Superlegeringsskum kunne gøre skibs- og flymotorer me -
 Ny flydende-metal-membranteknologi kan hjælpe med at gøre brintbrændselscellekøretøjer levedygt…Fra venstre, Pei-Shan Yen 16 (PhD), Ravindra Datta, professor i kemiteknik, og Nicholas Deveau 17 (PhD) ved Worcester Polytechnic Institute (WPI udviklede nye sandwichede flydende metalmembraner, der
Ny flydende-metal-membranteknologi kan hjælpe med at gøre brintbrændselscellekøretøjer levedygt…Fra venstre, Pei-Shan Yen 16 (PhD), Ravindra Datta, professor i kemiteknik, og Nicholas Deveau 17 (PhD) ved Worcester Polytechnic Institute (WPI udviklede nye sandwichede flydende metalmembraner, der -
 Reduktion af den energi, der kræves for at omdanne CO2-affald til værdifulde ressourcerKemisk og biomolekylær ingeniørprofessor og afdelingsformand Paul Kenis, ret, og kandidatstuderende Shawn Lu er medforfattere til en ny undersøgelse, der undersøger gennemførligheden af en ny CO2-sp
Reduktion af den energi, der kræves for at omdanne CO2-affald til værdifulde ressourcerKemisk og biomolekylær ingeniørprofessor og afdelingsformand Paul Kenis, ret, og kandidatstuderende Shawn Lu er medforfattere til en ny undersøgelse, der undersøger gennemførligheden af en ny CO2-sp
- Forskere opdager, hvordan celler reagerer på faste
- Hvor mange oz er 1 gram?
- Skitsere de grundlæggende trin i fremstillingen af protein?
- Første direkte observationer af metan øger drivhuseffekten på jordens overflade
- Forskning i edderkoppelim løser klæbrige problemer
- Kraft og træk rolle tydeliggjort for svømmende mikroorganismer


