Opløses ioniske forbindelser såsom chlorid NaCl let i vand?
* Polaritet: Vand er et polært molekyle, hvilket betyder, at det har en positiv ende og en negativ ende på grund af den ujævne deling af elektroner. Ioniske forbindelser er også polære, med deres positive og negative ioner tiltrukket af hinanden.
* attraktion: Når en ionisk forbindelse som NaCI placeres i vand, tiltrækkes den positive ende af vandmolekyler (hydrogen) af de negative chloridioner (Cl-), og den negative ende af vandmolekyler (ilt) tiltrækkes af de positive natriumioner (Na+).
* solvation: Denne attraktion overvinder kræfterne, der holder ionerne sammen i krystalgitteret. Vandmolekylerne omgiver ionerne, adskiller dem effektivt og holder dem opløst.
Nøglepunkt: En ionisk forbindelse til at opløses i vand afhænger af den relative styrke af tiltrækningen mellem ionerne og vandmolekylerne sammenlignet med tiltrækningen mellem ionerne selv.
Faktorer, der påvirker opløselighed:
* gitterenergi: Jo stærkere tiltrækningen mellem ioner i krystalgitteret er, desto mindre opløselig vil forbindelsen være.
* Hydratiseringsenergi: Jo stærkere tiltrækning mellem ioner og vandmolekyler, jo mere opløselig vil forbindelsen være.
Natriumchlorid har en relativt lav gitterenergi og en høj hydratiseringsenergi, hvilket gør det meget opløseligt i vand.
 Varme artikler
Varme artikler
-
 Sølvforing til ekstrem elektronikMSU-forskere udviklede en proces til at skabe mere modstandsdygtige kredsløb, hvilket de demonstrerede ved at skabe en sølvfarvet spartansk hjelm. Kredsløbet er designet af Jane Manfredi, en adjunkt v
Sølvforing til ekstrem elektronikMSU-forskere udviklede en proces til at skabe mere modstandsdygtige kredsløb, hvilket de demonstrerede ved at skabe en sølvfarvet spartansk hjelm. Kredsløbet er designet af Jane Manfredi, en adjunkt v -
 Stabiliserende egenskaber af grangummi kan justeres ved hjælp af ekstraktionsteknikkerFra højre:urenset grangummi opnået fra varmtvandsudvinding, grangummi opnået fra industristrømme, og renset grangummi. Kredit:Helsinki Universitet Biomasse opnået fra træ og de fraktioner, der udv
Stabiliserende egenskaber af grangummi kan justeres ved hjælp af ekstraktionsteknikkerFra højre:urenset grangummi opnået fra varmtvandsudvinding, grangummi opnået fra industristrømme, og renset grangummi. Kredit:Helsinki Universitet Biomasse opnået fra træ og de fraktioner, der udv -
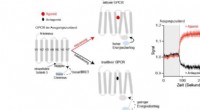 Et skridt foran inden for farmaceutisk forskningNye sensorer gør det muligt at måle aktivering eller deaktivering af GPCRer med high-throughput metoder. Kredit:Grafik:Hannes Schihada Hormoner og andre neurotransmittere, men også stoffer, virker
Et skridt foran inden for farmaceutisk forskningNye sensorer gør det muligt at måle aktivering eller deaktivering af GPCRer med high-throughput metoder. Kredit:Grafik:Hannes Schihada Hormoner og andre neurotransmittere, men også stoffer, virker -
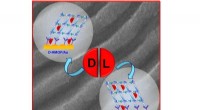 Forskere udvikler superfølsomme sensorer til spejlmolekyler i medicinKredit:Tomsk Polytechnic University (TPU) Forskere fra Tomsk Polytechnic University har sammen med kolleger fra Tjekkiet udviklet superfølsomme sensorer til påvisning af enantiomerer, kendt som sp
Forskere udvikler superfølsomme sensorer til spejlmolekyler i medicinKredit:Tomsk Polytechnic University (TPU) Forskere fra Tomsk Polytechnic University har sammen med kolleger fra Tjekkiet udviklet superfølsomme sensorer til påvisning af enantiomerer, kendt som sp
- Creative Biome Art Project Ideas
- Hvad mener du med en optisk fiber og forklare, at det fungerer et diagram?
- Hvornår er intensiteten af Suns -stråler størst?
- Hvordan er solhverv og jævndøgn relateret til positionen af jordens akse?
- Hvad sker der i kræftceller under opdeling?
- NASA viser, at den største nedbør er fordrevet i tyfonen Chan-hom


