Hvad er den mest sandsynlige reaktion mellem ammoniak og et vandmolekyle?
Her er hvorfor:
* Polaritet: Både ammoniak og vand er polære molekyler. Nitrogenatomet i ammoniak og iltatomet i vand har en delvis negativ ladning, mens brintatomerne har en delvis positiv ladning.
* Hydrogenbinding: De delvist positive hydrogenatomer i vand kan danne hydrogenbindinger med det ensomme par elektroner på nitrogenatomet i ammoniak. Disse brintbindinger er relativt svage, men er vigtige for egenskaberne ved både ammoniak og vand.
Her er den kemiske ligning, der repræsenterer interaktionen:
NH₃ + H₂O → NH₃… H₂O
Den stiplede linje indikerer en brintbinding.
Mens ammoniak også kan reagere med vand til dannelse af ammoniumioner (NH₄⁺) og hydroxidioner (OH⁻), er det mindre sandsynligt, at denne reaktion forekommer i nærvær af bare vand. Denne reaktion kræver en betydelig mængde energi for at bryde de stærke bindinger i vandmolekylet.
Fortæl mig, hvis du gerne vil have flere detaljer om nogen af disse reaktioner!
 Varme artikler
Varme artikler
-
 Forskere kaster nyt lys over påvisning af influenzaVirale kulturer er guldstandarden for diagnosticering af influenza, men det tager flere dage at udvikle sig. Ved at målrette et enzym, der er iboende for virussen og identificere dets tilstedeværelse
Forskere kaster nyt lys over påvisning af influenzaVirale kulturer er guldstandarden for diagnosticering af influenza, men det tager flere dage at udvikle sig. Ved at målrette et enzym, der er iboende for virussen og identificere dets tilstedeværelse -
 Fosforbaserede kompositter som anodematerialer til kalium-ion-batterierSkematisk illustration af de fosforbaserede kompositter som anodematerialer til KIBer. Kredit:WU Ying og HUANG Haibo Prof. WU Zhongshuai fra Dalian Institute of Chemical Physics (DICP) ved det kin
Fosforbaserede kompositter som anodematerialer til kalium-ion-batterierSkematisk illustration af de fosforbaserede kompositter som anodematerialer til KIBer. Kredit:WU Ying og HUANG Haibo Prof. WU Zhongshuai fra Dalian Institute of Chemical Physics (DICP) ved det kin -
 Bakterielle enzymer kapret til at skabe komplekse molekyler, der normalt fremstilles af planterKredit:CC0 Public Domain Kemikere ved Scripps Research har effektivt skabt tre familier af komplekse, oxygenholdige molekyler, der normalt kun kan opnås fra planter. Disse molekyler, kaldet terpe
Bakterielle enzymer kapret til at skabe komplekse molekyler, der normalt fremstilles af planterKredit:CC0 Public Domain Kemikere ved Scripps Research har effektivt skabt tre familier af komplekse, oxygenholdige molekyler, der normalt kun kan opnås fra planter. Disse molekyler, kaldet terpe -
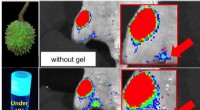 Team udvikler kræftbilleddannelseshjælp fra hestekastanjerMolekyler afledt af hestekastanjer hjælper kræftbilleddannelse. Kredit:City College i New York Forskning ved City College i New York viser, at kræftbilleddannelse kan forenkles ved en fotonisk pro
Team udvikler kræftbilleddannelseshjælp fra hestekastanjerMolekyler afledt af hestekastanjer hjælper kræftbilleddannelse. Kredit:City College i New York Forskning ved City College i New York viser, at kræftbilleddannelse kan forenkles ved en fotonisk pro
- Gravitationsbølger:Hvorfor balladen?
- Filtermembran gør vira harmløse
- Reaktion, der absorberer energi i form af varme?
- 3D-origami-kredsløb kan revolutionere elektroniske designs
- AI-drevet virtuel rotte giver indsigt i, hvordan hjerner styrer komplekse, koordinerede bevægelser
- Hvem kaldte stjerner ved at tildele dem til konstellationer og give græsk brev?


