Atomer af det samme element med forskellige atommasser?
Her er en sammenbrud:
* Element: Et stof bestående af kun en type atom. For eksempel er kulstof et element.
* atommasse: Massen af et atom, primært bestemt af antallet af protoner og neutroner i dens kerne.
* isotoper: Atomer med det samme element, der har det samme antal protoner (og dermed det samme atomnummer), men adskiller sig i antallet af neutroner. Dette betyder, at de har forskellige atommasser.
Eksempel:
* carbon-12: Har 6 protoner og 6 neutroner (atommasse =12)
* carbon-14: Har 6 protoner og 8 neutroner (atommasse =14)
Både carbon-12 og carbon-14 er isotoper af kulstof, fordi de begge har 6 protoner, men de adskiller sig i deres neutronantal, hvilket resulterer i forskellige atommasser.
Nøglepunkter om isotoper:
* samme kemiske egenskaber: Isotoper af det samme element har generelt de samme kemiske egenskaber, fordi de har det samme antal elektroner, der bestemmer kemisk binding.
* forskellige fysiske egenskaber: Isotoper kan have lidt forskellige fysiske egenskaber som densitet eller smeltepunkt.
* Radioaktive isotoper: Nogle isotoper er radioaktive, hvilket betyder, at deres kerner er ustabile og forfald over tid.
Forståelse af isotoper er afgørende på mange felter, herunder:
* Kemi: Radioaktive isotoper anvendes til datering og sporing af kemiske reaktioner.
* Medicin: Radioaktive isotoper bruges til medicinsk billeddannelse og behandling.
* Geologi: Radioaktive isotoper bruges til at datere klipper og fossiler.
 Varme artikler
Varme artikler
-
 Små molekylære bevægelser kan føre til mere effektive biobrændselscellerKredit:Leiden Universitet Leiden-forskere har fundet små bevægelser i laccase-enzymet. Denne opdagelse kan føre til udviklingen af meget mere effektive biobrændselsceller. Udgivelse i Biofysisk
Små molekylære bevægelser kan føre til mere effektive biobrændselscellerKredit:Leiden Universitet Leiden-forskere har fundet små bevægelser i laccase-enzymet. Denne opdagelse kan føre til udviklingen af meget mere effektive biobrændselsceller. Udgivelse i Biofysisk -
 Dampanalyse i realtid kan forbedre træning af hunde, der registrerer eksplosive stofferKredit:American Chemical Society Med en lugtesans meget større end mennesker, hunde betragtes som guldstandarden for eksplosiv detektion i mange situationer. Men det betyder ikke, at der ikke er p
Dampanalyse i realtid kan forbedre træning af hunde, der registrerer eksplosive stofferKredit:American Chemical Society Med en lugtesans meget større end mennesker, hunde betragtes som guldstandarden for eksplosiv detektion i mange situationer. Men det betyder ikke, at der ikke er p -
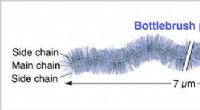 Verdens længste flaskebørstepolymer nogensinde syntetiseretFlaskebørstepolymer er en polymer bestående af en enkelt hovedkæde og adskillige sidekæder podet fra hovedkæden. Kredit:National Institute for Materials Science NIMS og RIKEN er lykkedes med at sy
Verdens længste flaskebørstepolymer nogensinde syntetiseretFlaskebørstepolymer er en polymer bestående af en enkelt hovedkæde og adskillige sidekæder podet fra hovedkæden. Kredit:National Institute for Materials Science NIMS og RIKEN er lykkedes med at sy -
 Passer én størrelse alle? En ny model for organiske halvledereRepræsentation af bærermobilitet i hårde uorganiske materialer (øverste figur, båndtransport) og fleksible organiske faste stoffer (nedre tal, fleksibilitetsinduceret transportmekanisme). Kredit:Kazuy
Passer én størrelse alle? En ny model for organiske halvledereRepræsentation af bærermobilitet i hårde uorganiske materialer (øverste figur, båndtransport) og fleksible organiske faste stoffer (nedre tal, fleksibilitetsinduceret transportmekanisme). Kredit:Kazuy
- Hvad er det svageste træ i verden?
- Tatoveringselektroder fra en ink-jet printer til langsigtet medicinsk diagnostik
- Hvad er konverteringen fra 0,710 oz til gram i guld?
- Hvad er skalaernes funktion på krybdyr?
- Hvordan opfatter og ser det menneskelige øje måne på nattehimlen?
- Er gede wattles en dominerende eller recessiv egenskab?


