Hvorfor er atomer af metaller og ikke reaktive?
* Metallisk binding: Metaller har en unik bindingsstruktur, hvor deres ydre elektroner er løst bundet til atomerne. Disse elektroner danner et "hav" af delokaliserede elektroner, der let kan bevæge sig gennem metallet.
* Elektropositivitet: Metaller har en tendens til at have lave ioniseringsenergier, hvilket betyder, at de let mister elektroner for at danne positive ioner (kationer).
* reaktivitet: Denne kombination af faktorer gør metaller meget reaktive. De har en tendens til let at reagere med andre elementer for at opnå en stabil elektronkonfiguration ved at miste elektroner.
Her er en sammenbrud af, hvorfor metaller er reaktive:
* reaktion med ilt: Mange metaller reagerer med ilt for at danne oxider. For eksempel reagerer jern med ilt for at danne jernoxid (RUST).
* reaktion med syrer: Metaller reagerer med syrer for at producere brintgas og et salt. For eksempel reagerer zink med saltsyre for at producere zinkchlorid og brintgas.
* reaktion med vand: Nogle metaller reagerer med vand for at danne metalhydroxider og brintgas. For eksempel reagerer natrium kraftigt med vand.
Bemærk: Der er nogle få undtagelser fra denne generelle tendens. Nogle metaller, som guld og platin, er relativt ureaktive på grund af deres høje ioniseringsenergier og stabile elektronkonfigurationer.
Sammenfattende er metaller generelt reaktive på grund af deres metalliske binding og tendens til at miste elektroner.
Sidste artikelAtomer af det samme element med forskellige atommasser?
Næste artikelHvordan beskriver uorganisk et mineral?
 Varme artikler
Varme artikler
-
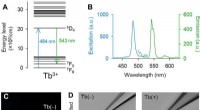 Terbium (III)-doteret fluorescerende glas til biomedicinsk forskningTb3+-doterede pipetter udsender grøn fluorescens. (A) Partielt energiniveaudiagram af Tb3+ [ekstraheret delvist fra (14)]. (B) Excitation (blå) og emission (grøn) spektre af 3,1 mol % Tb3+-doteret gla
Terbium (III)-doteret fluorescerende glas til biomedicinsk forskningTb3+-doterede pipetter udsender grøn fluorescens. (A) Partielt energiniveaudiagram af Tb3+ [ekstraheret delvist fra (14)]. (B) Excitation (blå) og emission (grøn) spektre af 3,1 mol % Tb3+-doteret gla -
 Hvorfor løg får os til at græde (og hvorfor nogle ikke gør det)Kredit:Shutterstock Mark Anthony i Shakespeares Cleopatra kan have henvist til tårerne, der lever i løget. Men hvorfor får løg os egentlig til at græde? Og hvorfor er det kun nogle løg, der får os
Hvorfor løg får os til at græde (og hvorfor nogle ikke gør det)Kredit:Shutterstock Mark Anthony i Shakespeares Cleopatra kan have henvist til tårerne, der lever i løget. Men hvorfor får løg os egentlig til at græde? Og hvorfor er det kun nogle løg, der får os -
 Enzymer med succes indlejret i plastProduktion af en biofunktionaliseret film i forarbejdningspilotanlægget. Kredit:Fraunhofer IAP Generelt, plast bliver behandlet ved langt over hundrede grader celsius. Enzymer, derimod, kan normal
Enzymer med succes indlejret i plastProduktion af en biofunktionaliseret film i forarbejdningspilotanlægget. Kredit:Fraunhofer IAP Generelt, plast bliver behandlet ved langt over hundrede grader celsius. Enzymer, derimod, kan normal -
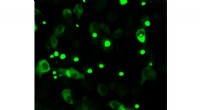 Ny indsigt i Huntingtons sygdomHumane celler, der producerer fluorescens-mærket mutant huntingtin. Muteret huntingtin har en tendens til at akkumulere, hvilket er patologisk og synligt i form af prikker. Kredit:Bremen Universitet
Ny indsigt i Huntingtons sygdomHumane celler, der producerer fluorescens-mærket mutant huntingtin. Muteret huntingtin har en tendens til at akkumulere, hvilket er patologisk og synligt i form af prikker. Kredit:Bremen Universitet
- Hvilken type zone findes i det åbne hav?
- Ø-hopping:Genetik afslører, hvordan mennesker bosatte sig i det fjerne Stillehav
- NASAs nye chef ændrer mening, tror nu på klimaændringer
- Hvad kredserer Mælkevejen Galaxy på sin enorme kosmiske rejse gennem universet?
- Er solen et spørgsmål om gas?
- Supercomputermodelsimuleringer afslører årsagen til neandertalerens udryddelse


