Hvad er molmasse i kemi?
Molmasse i kemi:Massen af en mol
Molmasse er et grundlæggende koncept inden for kemi, der definerer masse af en mol af et stof .
Her er en sammenbrud:
* mol (mol): En måleenhed, der repræsenterer et specifikt antal partikler (atomer, molekyler, ioner osv.). En mol indeholder 6,022 x 10^23 partikler , også kendt som avogadros nummer .
* molmasse (g/mol): Massen af en mol af et stof udtrykt i gram pr. Mol (g/mol).
hvordan man bestemmer molmasse:
Du kan finde den molære masse af et element ved at se på dets atommasse På den periodiske tabel. Denne værdi repræsenterer den gennemsnitlige masse af et atom af dette element i atommasseenheder (AMU). Da 1 AMU er omtrent lig med 1 g/mol, er atommassen numerisk lig med elementets molære masse.
For forbindelser , skal du tilføje de molære masser af alle de tilstedeværende elementer under hensyntagen til antallet af hvert element i forbindelsens formel.
Eksempler:
* brint (H): Molmasse =1,008 g/mol (fra den periodiske tabel)
* vand (H₂O): Molmasse =(2 x 1,008 g/mol) + 15,999 g/mol =18,015 g/mol
* natriumchlorid (NaCl): Molmasse =22,990 g/mol + 35,453 g/mol =58,443 g/mol
Hvorfor er molmasse vigtig?
Molmasse er afgørende i kemi, fordi det giver os mulighed for at:
* Konverter mellem masse og mol: Dette er vigtigt for mange beregninger, såsom bestemmelse af mængden af reaktanter, der er nødvendige for en specifik kemisk reaktion.
* Beregn koncentrationen af opløsninger: Ved hjælp af molmasse kan vi udtrykke koncentrationen af en opløsning i molaritetsenheder (mol pr. Liter).
* Forstå støkiometrien af reaktioner: Kemiske ligninger viser forholdet mellem mol reaktanter og produkter involveret i en reaktion. Molmasse giver os mulighed for at konvertere disse forhold til gram, hvilket gør det lettere at arbejde med mængder i den virkelige verden.
I det væsentlige fungerer molmasse som en bro mellem den mikroskopiske verden af atomer og molekyler og den makroskopiske verden, vi oplever. Det hjælper os med at forstå de mængder, der er involveret i kemiske reaktioner og processer, hvilket gør det til et vigtigt værktøj for kemikere.
 Varme artikler
Varme artikler
-
 Ved hjælp af to CRISPR -enzymer, en COVID -diagnose på kun 20 minutterReaktionerne involveret i FIND-IT-assayet for at påvise infektion med SARS-CoV-2-virussen. Når Cas13 -enzymet (nederst til venstre) binder sig til sit mål -RNA, det klipper et molekyle (orange og lyse
Ved hjælp af to CRISPR -enzymer, en COVID -diagnose på kun 20 minutterReaktionerne involveret i FIND-IT-assayet for at påvise infektion med SARS-CoV-2-virussen. Når Cas13 -enzymet (nederst til venstre) binder sig til sit mål -RNA, det klipper et molekyle (orange og lyse -
 Oprettelse af længerevarende brændselscellerEt team af ingeniører ved Washington University i St. Louis har udviklet en ny måde at se inde i brændselsceller, i et forsøg på at forhindre oxidation, der kan forkorte deres levetid. Kredit:Washingt
Oprettelse af længerevarende brændselscellerEt team af ingeniører ved Washington University i St. Louis har udviklet en ny måde at se inde i brændselsceller, i et forsøg på at forhindre oxidation, der kan forkorte deres levetid. Kredit:Washingt -
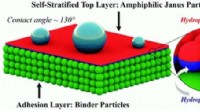 Forskning viser potentiale til at forbedre maling, belægningerKredit: Materialer Horisonter (2020). DOI:10.1039/D0MH00589D Ny forskning fra Binghamton University, State University of New York kan føre til mere miljøvenlige malinger og belægninger. I romers
Forskning viser potentiale til at forbedre maling, belægningerKredit: Materialer Horisonter (2020). DOI:10.1039/D0MH00589D Ny forskning fra Binghamton University, State University of New York kan føre til mere miljøvenlige malinger og belægninger. I romers -
 Stopper svovl-shuttlen for bedre batterierAt inkorporere et lag hierarkisk porøst grafen i lithium-svovl-batterier hjælper med at overvinde en af de største begrænsninger ved disse typer batterier. Kredit:2021 KAUST; Anastasia Serin Eft
Stopper svovl-shuttlen for bedre batterierAt inkorporere et lag hierarkisk porøst grafen i lithium-svovl-batterier hjælper med at overvinde en af de største begrænsninger ved disse typer batterier. Kredit:2021 KAUST; Anastasia Serin Eft
- Fakta om menneskeskallen til børn
- Hvad er skyerne af støv og gas, hvor stjerner er født?
- Hvorfor ser dosis solen ud som den bevægende?
- Er oxygen 17 og 18 de samme isotoper af oxygen?
- Den hemmelige ingrediens i organisatorisk langsigtet succes? Tilpas til offentlighedens forventninge…
- At bryde formen:Et usædvanligt materialevalg giver utroligt langtidsholdbare batterier


