Ved hjælp af to CRISPR -enzymer, en COVID -diagnose på kun 20 minutter
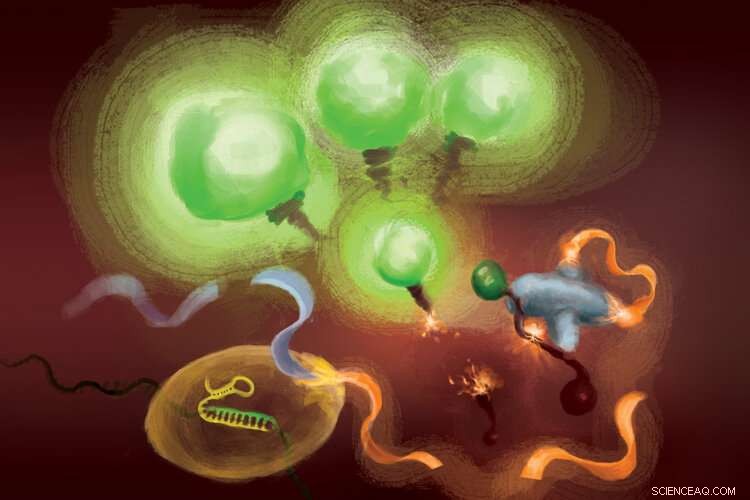
Reaktionerne involveret i FIND-IT-assayet for at påvise infektion med SARS-CoV-2-virussen. Når Cas13 -enzymet (nederst til venstre) binder sig til sit mål -RNA, det klipper et molekyle (orange og lyseblåt bånd) for at frigive en aktivator (orange), der overlader Csm6 -nukleasen (til højre) for at spalte og frigive fluorescerende molekyler, der lyser (grønt) og signalerer tilstedeværelsen af viralt RNA. Kredit:Margaret L. Liu, University of Chicago Pritzker School of Medicine.
Hyppig, hurtig test for COVID-19 er afgørende for at kontrollere spredningen af udbrud, især som ny, flere overførbare varianter dukker op.
Mens dagens guldstandard COVID-19 diagnostiske test, som bruger qRT-PCR-kvantitativ reverse-transcriptase-polymerasekædereaktion (PCR)-er ekstremt følsom, detekterer ned til en kopi af RNA pr. mikroliter, det kræver specialudstyr, en driftstid på flere timer og et centraliseret laboratoriefacilitet. Som resultat, test tager typisk mindst en til to dage.
Et forskerhold ledet af forskere i Jennifer Doudnas laboratorier, David Savage og Patrick Hsu ved University of California, Berkeley, sigter mod at udvikle en diagnostisk test, der er meget hurtigere og lettere at implementere end qRT-PCR. Det har nu kombineret to forskellige typer CRISPR -enzymer for at oprette et assay, der kan påvise små mængder viralt RNA på mindre end en time. Doudna delte Nobelprisen i kemi i 2020 for opfindelsen af CRISPR-Cas9 genomredigering.
Selvom den nye teknik endnu ikke er på det stadie, hvor den konkurrerer med følsomheden af qRT-PCR, som kun kan registrere et par kopier af viruset pr. mikroliter væske, det er allerede i stand til at opfange niveauer af viralt RNA - cirka 30 kopier pr. mikroliter - tilstrækkeligt til at blive brugt til at overvåge befolkningen og begrænse spredningen af infektioner.
"Du behøver ikke PCR's følsomhed for stort set at fange og diagnosticere COVID-19 i samfundet, hvis testen er praktisk nok og hurtig nok, "sagde medforfatter David Savage, professor i molekylær og cellebiologi. "Vores håb var at køre biokemien så langt som muligt til det punkt, hvor du kunne forestille dig et meget bekvemt format i en indstilling, hvor du kan blive testet hver dag, sige, ved indgangen til arbejdet. "
Forskerne vil rapportere deres resultater online den 5. august i tidsskriftet Naturens kemiske biologi .
Flere CRISPR-baserede assays er blevet godkendt til brug i nødstilfælde af Food and Drug Administration, men alle kræver et indledende trin, hvor det virale RNA forstærkes, så detektionssignalet - som involverer frigivelse af et fluorescerende molekyle, der lyser under blåt lys - er lyst nok til at se. Selvom denne indledende forstærkning øger testens følsomhed til et lignende niveau som qRT-PCR, den introducerer også trin, der gør testen vanskeligere at udføre uden for et laboratorium.
Det UC Berkeley-ledede team forsøgte at nå en nyttig følsomhed og hastighed uden at ofre analysens enkelhed.
"Til plejeprogrammer, du vil have et hurtigt svar, så folk hurtigt kan vide, om de er inficeret eller ej, før du tager på et fly, for eksempel, eller besøg slægtninge, "sagde teamleder Tina Liu, forsker i Doudnas laboratorium ved Innovative Genomics Institute (IGI), et CRISPR-fokuseret center med UC Berkeley og UC San Francisco forskere.
Bortset fra at have et ekstra trin, en anden ulempe ved initial forstærkning er, at fordi det laver milliarder af kopier af viralt RNA, der er større chance for krydskontaminering på tværs af patientprøver. Den nye teknik udviklet af teamet vender dette rundt og øger i stedet det fluorescerende signal, eliminering af en vigtig kilde til krydskontaminering.
Den forstærkningsfrie teknik, som de betegner Fast Integrated Nuclease Detection In Tandem (FIND-IT), kunne muliggøre hurtige og billige diagnostiske tests for mange andre infektionssygdomme.
"Mens vi startede dette projekt med det udtrykkelige formål at påvirke COVID-19, Jeg tror, at denne særlige teknik kunne være anvendelig på mere end bare denne pandemi, fordi, ultimativt, CRISPR er programmerbar, "Sagde Liu." Så, du kan indlæse CRISPR -enzymet med en sekvens, der er målrettet mod influenzavirus eller HIV -virus eller enhver form for RNA -virus, og systemet har potentiale til at fungere på samme måde. Dette papir fastslår virkelig, at denne biokemi er en enklere måde at detektere RNA på og har evnen til at opdage det RNA inden for en følsom og hurtig tidsramme, der kunne være egnet til fremtidige applikationer inden for plejediagnostik. "
Forskerne er i øjeblikket i gang med at opbygge en sådan diagnose ved hjælp af FIND-IT, som ville omfatte trin til at indsamle og behandle prøver og til at køre assayet på en kompakt mikrofluidisk enhed.
Brug af tandem Cas -proteiner
For at fjerne målforstærkning fra ligningen, teamet anvendte et CRISPR -enzym - Cas13 - til først at påvise det virale RNA, og en anden type Cas -protein, kaldet Csm6, at forstærke fluorescenssignalet.
Cas13 er en almindelig sakse til skæring af RNA; når den binder sig til sin målsekvens, specificeret af et vejledende RNA, det er primet til at skære en bred vifte af andre RNA -molekyler. Denne måludløste skæreaktivitet kan udnyttes til pardetektion af en specifik RNA-sekvens til frigivelse af et fluorescerende reportermolekyle. Imidlertid, på egen hånd, Cas13 kan kræve timer at generere et påviseligt signal, når der er meget små mængder mål -RNA til stede.
Lius indsigt var at bruge Csm6 til at forstærke effekten af Cas13. Csm6 er et CRISPR -enzym, der registrerer tilstedeværelsen af små RNA -ringe og aktiveres for at skære en bred vifte af RNA -molekyler i celler.
For at øge Cas13 -opdagelsen, hun og hendes kolleger designede et specielt konstrueret aktivatormolekyle, der bliver skåret, når Cas13 detekterer viralt RNA. Et fragment af dette molekyle kan binde til og få Csm6 til at skære og frigive et lyst fluorescerende molekyle fra et stykke RNA. Normalt, aktivatormolekylet nedbrydes hurtigt af Csm6, begrænser dermed mængden af fluorescerende signal, det kan generere. Liu og hendes kolleger udtænkte en måde at kemisk modificere aktivatoren, så den er beskyttet mod nedbrydning og kan overlade Csm6 til gentagne gange at skære og frigive fluorescerende molekyler, der er knyttet til RNA. Dette resulterer i en følsomhed, der er 100 gange bedre end den originale aktivator.
"Når Cas13 bliver aktiveret, det kløver denne lille aktivator, fjernelse af et segment, der beskytter det, "Sagde Liu." Nu hvor det er frigjort, det kan aktivere masser af forskellige molekyler af det andet enzym, Csm6. Også, et mål anerkendt af Cas13 fører ikke bare til aktivering af sin egen RNA-skæringsevne; det fører til dannelsen af mange flere aktive enzymer, der hver derefter kan spalte endnu flere fluorescerende journalister. "
Forskerteamet indarbejdede også en optimeret kombination af guide -RNA'er, der muliggør mere sensitiv genkendelse af viralt RNA af Cas13. Da dette blev kombineret med Csm6 og dets aktivator, holdet var i stand til at opdage ned til 31 kopier pr. mikroliter SARS-CoV-2 RNA på så lidt som 20 minutter.
Forskerne tilføjede også ekstraheret RNA fra patientprøver til FIND-IT-assayet i en mikrofluidpatron, for at se, om denne analyse kunne tilpasses til at køre på en bærbar enhed. Brug af en lille enhed med et kamera, de kunne opdage SARS-CoV-2 RNA ekstraheret fra patientprøver med en følsomhed, der ville fange COVID-19 infektioner på deres højeste.
"Denne tandem -nukleasetilgang - Cas13 plus Csm6 - kombinerer alt til en enkelt reaktion ved en enkelt temperatur, 37 grader Celsius, så det ikke kræver høj temperatur opvarmning eller flere trin, som det er nødvendigt for andre diagnostiske teknikker, "Liu sagde." Jeg tror, det åbner muligheder for hurtigere, enklere tests, der kan nå en sammenlignelig følsomhed over for andre nuværende teknikker og potentielt kan nå endnu højere følsomheder i fremtiden. "
Udviklingen af denne amplifikationsfrie metode til RNA-detektion skyldes en omorientering af forskning inden for IGI, da pandemien begyndte mod problemer med COVID-19-diagnose og behandling. Ultimativt, fem laboratorier ved UC Berkeley og to laboratorier ved UCSF blev involveret i dette forskningsprojekt, en af mange inden for IGI.
"Da vi startede dette, vi havde håb om at skabe noget, der nåede paritet med PCR, men krævede ikke forstærkning - det ville være drømmen, sagde Savage, der var hovedforsker for projektet. "Og fra et følsomhedsperspektiv, vi havde et ti tusinde gange hul at springe. Vi har gjort det omkring tusind gange; vi har drevet den ned omkring tre størrelsesordener. Så, vi er der næsten. April sidste år, da vi virkelig begyndte at kortlægge det, det virkede næsten umuligt. "
 Varme artikler
Varme artikler
-
 Opdagelse af en nål i en høstak i jagten på at låse op for ren energiteknologiKredit:CC0 Public Domain Forskere fra University of Aberdeen har opdaget en ny familie af kemiske forbindelser, der kan revolutionere brændselscelleteknologi og hjælpe med at reducere de globale C
Opdagelse af en nål i en høstak i jagten på at låse op for ren energiteknologiKredit:CC0 Public Domain Forskere fra University of Aberdeen har opdaget en ny familie af kemiske forbindelser, der kan revolutionere brændselscelleteknologi og hjælpe med at reducere de globale C -
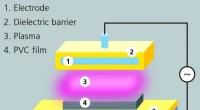 Plasmabehandling reducerer migration af blødgørere fra blodposerEksperimentel samling til DBD (dielektrisk barriereudladning) behandling af PVC-film. Kredit:Fraunhofer IST Medicinske produkter som blodposer og slanger er ofte fremstillet af blød PVC, en plasti
Plasmabehandling reducerer migration af blødgørere fra blodposerEksperimentel samling til DBD (dielektrisk barriereudladning) behandling af PVC-film. Kredit:Fraunhofer IST Medicinske produkter som blodposer og slanger er ofte fremstillet af blød PVC, en plasti -
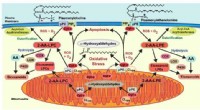 Hvad sker der med plasmalogener, fosfolipiderne ingen kan lide at tænke påDiagram viser signalveje påvirket af cytochrom cs nedbrydning af plasmalogen. Kredit:Richard Gross Patienter med Alzheimers sygdom mister op til 60 % af en komponent kaldet plasmalogen fra membran
Hvad sker der med plasmalogener, fosfolipiderne ingen kan lide at tænke påDiagram viser signalveje påvirket af cytochrom cs nedbrydning af plasmalogen. Kredit:Richard Gross Patienter med Alzheimers sygdom mister op til 60 % af en komponent kaldet plasmalogen fra membran -
 Hurtige tests til tidlig diagnose af hjerteanfald og identifikation af sepsisHøjpræcisionsautomatisk dispenser til præcis påføring af specifikke reagenser. Kredit:©NUST MISIS NUST MISIS-forskere har udviklet en ny type membranteststrimmel til en kvantitativ immunokromatogr
Hurtige tests til tidlig diagnose af hjerteanfald og identifikation af sepsisHøjpræcisionsautomatisk dispenser til præcis påføring af specifikke reagenser. Kredit:©NUST MISIS NUST MISIS-forskere har udviklet en ny type membranteststrimmel til en kvantitativ immunokromatogr
- Kunstig intelligens fremskynder indsatsen for at udvikle ren, praktisk talt ubegrænset fusionsenerg…
- Sådan beregnes en Blast Radius
- Belysning af uønskede urenheders rolle i galliumnitrid-halvledere
- Overvågning af europæisk lufttrafik med jordobservation
- Astronomer undersøger oprindelsen af Planet 9
- Shadow-netværk holder samfund sikre mod dødbringende vulkan


