En gasforbindelse er 78,14 procent bor og 21,86 brint ved 27C 74,3 ml af det udøvede et tryk 1,12 atm, hvis masse var 0,0934 g Hvad er dens molekylære formel?
1. Find den empiriske formel:
* Antag en 100 g prøve: Dette gør procenterne direkte til gram.
* Konverter gram til mol:
* Mol Boron (B):78,14 g / 10,81 g / mol (molmasse B) =7,23 mol
* Mol brint (H):21,86 g / 1,01 g / mol (molmasse H) =21,64 mol
* Find det enkleste forhold mellem hele nummer: Del begge molværdier med den mindre (7,23 mol):
* B:7,23 mol / 7,23 mol =1
* H:21,64 mol / 7,23 mol ≈ 3
* Empirisk formel: Bh₃
2. Bestem den molære masse:
* Brug den ideelle gaslov (PV =NRT):
* P =1,12 atm
* V =74,3 ml =0,0743 L
* R =0,0821 l⋅atm/(mol⋅k)
* T =27 ° C + 273,15 =300,15 K
* Løs for N (antal mol):
* n =(pv) / (rt) =(1,12 atm * 0,0743 l) / (0,0821 l⋅atm / (mol⋅k) * 300,15 K) ≈ 0,0034 mol
* Beregn molmasse:
* Molmasse =masse / mol =0,0934 g / 0,0034 mol ≈ 27,5 g / mol
3. Bestem den molekylære formel:
* Find forholdet mellem den molære masse og den empiriske formelmasse:
* Empirisk formelmasse på BH₃ =10,81 g/mol + 3 (1,01 g/mol) =13,84 g/mol
* Forhold =27,5 g/mol/13,84 g/mol ≈ 2
* Multiplicer underskrifterne i den empiriske formel med forholdet:
* Molekylær formel:(bh₃) ₂ = b₂h₆
Derfor er den molekylære formel for gasforbindelsen b₂h₆.
 Varme artikler
Varme artikler
-
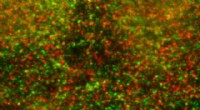 Hvordan celler genanvendes deres affaldsbortskaffelsessystemer for at fremme betændelseEndotelceller farvet med antistoffer til sporing af GPCR (vist med grønt) og E3 -ligase (vist med rødt) og påvist ved immunfluorescens konfokal mikroskopi. Kredit:UC San Diego Health G-proteinkobl
Hvordan celler genanvendes deres affaldsbortskaffelsessystemer for at fremme betændelseEndotelceller farvet med antistoffer til sporing af GPCR (vist med grønt) og E3 -ligase (vist med rødt) og påvist ved immunfluorescens konfokal mikroskopi. Kredit:UC San Diego Health G-proteinkobl -
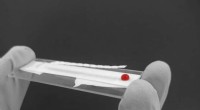 Radikal diagnostik kan redde millioner af mennesker, der risikerer at dø af blodtabFibrinogendiagnostik udviklet af forskere ved Monash University. Kredit:Monash University / BioPRIA Ingeniører ved Monash University i Australien har udviklet en hurtig, bærbar og billig diagnosti
Radikal diagnostik kan redde millioner af mennesker, der risikerer at dø af blodtabFibrinogendiagnostik udviklet af forskere ved Monash University. Kredit:Monash University / BioPRIA Ingeniører ved Monash University i Australien har udviklet en hurtig, bærbar og billig diagnosti -
 Ny miljøvenlig syntesemetode bruger aluminiumoxid som en genanvendelig katalysatorFigur 1. Et kommercielt tilgængeligt aluminiumoxidpulver. Kredit:Kobe University Et internationalt forskningssamarbejde mellem Kobe University og Inner Mongolia Medical University har udviklet en e
Ny miljøvenlig syntesemetode bruger aluminiumoxid som en genanvendelig katalysatorFigur 1. Et kommercielt tilgængeligt aluminiumoxidpulver. Kredit:Kobe University Et internationalt forskningssamarbejde mellem Kobe University og Inner Mongolia Medical University har udviklet en e -
 Forbedring af sammensætningen af strålebeskyttelsesbrillerForskere vælger den optimale sammensætning af briller, som vil have stærke beskyttende egenskaber, klarhed og miljøvenlighed. Kredit:UrFU / Anastasia Farafontova. Forskere ved Ural Federal Universi
Forbedring af sammensætningen af strålebeskyttelsesbrillerForskere vælger den optimale sammensætning af briller, som vil have stærke beskyttende egenskaber, klarhed og miljøvenlighed. Kredit:UrFU / Anastasia Farafontova. Forskere ved Ural Federal Universi
- Hvilke træk ved fotosyntesen og cellulære respirationsbiokemiske veje er omvendt hinanden, hvilke …
- DNA Model Project Ideas
- Video:Skal julemanden have et flammehæmmende jakkesæt på?
- Nye nanokrystaller med avancerede optiske egenskaber udviklet til brug som selvlysende biomarkører
- Når man studerer en molekyle -kemiker, kan det være model af til?
- race, etniske minoriteter står over for større sårbarhed over for naturbrande


