Hvorfor klassificeres dannelsen af klor som oxidation?
Her er hvorfor:
* Oxidation er processen med at miste elektroner.
* reduktion er processen med at vinde elektroner.
I dannelsen af klorgas opstår følgende reaktion:
2 cl⁻ → cl₂ + 2e⁻
* chloridioner (cl⁻) Hver har et gebyr på -1, hvilket betyder, at de har fået en elektron.
* I dannelsen af klorgas (cl₂) mister de Disse elektroner til at blive neutrale kloratomer.
* Disse neutrale kloratomer binder derefter sig sammen for at danne klorgas.
Da chloridionerne mister elektroner, klassificeres denne proces som oxidation.
Det er vigtigt at huske, at oxidation og reduktion altid forekommer sammen i en proces kaldet redox -reaktion . I dette tilfælde oxideres klorionerne, mens noget andet reduceres. Dette kan være et andet element eller forbindelse, der får de elektroner, der er mistet ved chloridionerne.
Sidste artikelNår et kaliumatom reagerer med brom viljen?
Næste artikelHvad er oxidationstilstanden PCL5?
 Varme artikler
Varme artikler
-
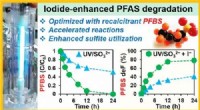 PFAS-kemikalier holder ikke evigtGrafisk abstrakt. Kredit:Environmental Science &Technology (2022). DOI:10.1021/acs.est.1c07608 Når de først er blevet kaldt kemikalier for evigt, kan per- og polyfluoralkyl-stoffer eller PFAS være
PFAS-kemikalier holder ikke evigtGrafisk abstrakt. Kredit:Environmental Science &Technology (2022). DOI:10.1021/acs.est.1c07608 Når de først er blevet kaldt kemikalier for evigt, kan per- og polyfluoralkyl-stoffer eller PFAS være -
 3-D-printharpikser i tandudstyr kan være giftige for reproduktiv sundhedKredit:CC0 Public Domain To kommercielt tilgængelige 3-D-printbare harpikser, som markedsføres som værende biokompatible til brug i dentale applikationer, let udvaskes forbindelser i deres omgivel
3-D-printharpikser i tandudstyr kan være giftige for reproduktiv sundhedKredit:CC0 Public Domain To kommercielt tilgængelige 3-D-printbare harpikser, som markedsføres som værende biokompatible til brug i dentale applikationer, let udvaskes forbindelser i deres omgivel -
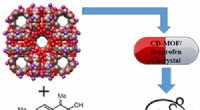 Længerevarende smertelindring med MOF'erKredit:American Chemical Society Til behandling af hovedpine, rygsmerter eller feber, de fleste af os har nået ibuprofen på et eller andet tidspunkt. Men vi skal ofte tage doser hver fjerde til sj
Længerevarende smertelindring med MOF'erKredit:American Chemical Society Til behandling af hovedpine, rygsmerter eller feber, de fleste af os har nået ibuprofen på et eller andet tidspunkt. Men vi skal ofte tage doser hver fjerde til sj -
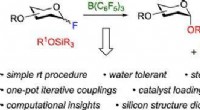 Syntetisering af sukker:Kemikere udvikler metode til at forenkle opbygning af kulhydraterKredit:ACS Kulhydrater er komplekse molekyler, svært at syntetisere i laboratoriet, men det er nyttigt at studere gavnlige sukkerarter, såsom dem, der findes i modermælk, eller gør det muligt for
Syntetisering af sukker:Kemikere udvikler metode til at forenkle opbygning af kulhydraterKredit:ACS Kulhydrater er komplekse molekyler, svært at syntetisere i laboratoriet, men det er nyttigt at studere gavnlige sukkerarter, såsom dem, der findes i modermælk, eller gør det muligt for
- Hvad er fordelene ved biomasse som energikilde?
- Hvordan man laver elektricitet fra radiobølger
- Hvilken type krystaltekstur dannes, når magma afkøles langsomt inden for varm sten under jorden?
- Hvad er kvanteteori vinkel?
- Kan en 5 amp termostatkontakt håndtere 6,5 ampere?
- Fysikere forlænger stokastisk termodynamik dybere ind i kvanteområdet


