Hvordan kan der dannes et natriumatomforbindelse med chloratom?
forståelse af det grundlæggende
* natrium (NA): Natrium har en valenselektron (elektron i sin yderste skal). Den ønsker at miste denne elektron for at opnå en stabil elektronkonfiguration som en ædel gas (neon).
* klor (Cl): Klor har syv valenselektroner. Den ønsker at få en elektron for at opnå en stabil elektronkonfiguration som den ædle gas -argon.
reaktionen
1. Elektronoverførsel: Natriumatomet overfører sin enkelt valenselektron til chloratomet.
2. ioniske bindinger: Natriumatomet, efter at have mistet et elektron, bliver positivt ladet (Na+) og kaldes nu en natriumion. Chloratomet, efter at have fået et elektron, bliver negativt ladet (CL-) og kaldes nu en chloridion.
3. Elektrostatisk attraktion: De modsatte ladede ioner er stærkt tiltrukket af hinanden på grund af elektrostatiske kræfter og danner en ionisk binding.
resultat
Den resulterende forbindelse, natriumchlorid (NaCl), er en krystalgitterstruktur. I denne struktur er hver natriumion omgivet af seks chloridioner, og hver chloridion er omgivet af seks natriumioner. Denne stærke elektrostatiske attraktion mellem ionerne giver natriumchlorid dets høje smeltepunkt og en stærk krystalstruktur.
Nøglepunkter
* ioniske forbindelser: Natriumchlorid er et eksempel på en ionisk forbindelse, dannet af den elektrostatiske tiltrækning mellem modsat ladede ioner.
* octet regel: Både natrium og klor opnår en stabil elektronkonfiguration ved at vinde eller miste elektroner for at have otte elektroner i deres yderste skal (Octet -regel).
Fortæl mig, hvis du har andre spørgsmål!
Sidste artikelHvorfor flyder aluminium på vand og ethanol, men synker acetone?
Næste artikelHvordan reagerer syre med glas?
 Varme artikler
Varme artikler
-
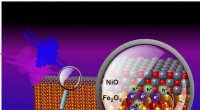 Styring af ladningsflow ved at styre elektronhullerForskere bruger ekstreme ultraviolette pulser (fuchsia linje) til at bestemme, hvordan synligt lys (blå linje) forårsager grænsefladehul (h + ) overførsel fra jernoxid (Fe 2 O 3 ) til nikkeloxid
Styring af ladningsflow ved at styre elektronhullerForskere bruger ekstreme ultraviolette pulser (fuchsia linje) til at bestemme, hvordan synligt lys (blå linje) forårsager grænsefladehul (h + ) overførsel fra jernoxid (Fe 2 O 3 ) til nikkeloxid -
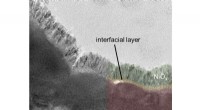 Solbrint:Fotoanoder lover høj effektivitetTEM-billede af en α-SnWO4 film (grøn) overtrukket med 20 nm NiOx (pink). Ved grænsefladen mellem α-SnWO4 og NiOx kan et yderligere grænsefladelag observeres. Kredit:HZB Fotoanoder fremstillet af m
Solbrint:Fotoanoder lover høj effektivitetTEM-billede af en α-SnWO4 film (grøn) overtrukket med 20 nm NiOx (pink). Ved grænsefladen mellem α-SnWO4 og NiOx kan et yderligere grænsefladelag observeres. Kredit:HZB Fotoanoder fremstillet af m -
 Et strejf salt kan styrke MXene -supermaterialer mod oxidationVed at kombinere et almindeligt føde- og vandadditiv, pholyphosphatsalte, med MXene materialer, forskere på Drexel har opdaget en måde at bremse oxidationsprocessen på, når de udsættes for vand. Kredi
Et strejf salt kan styrke MXene -supermaterialer mod oxidationVed at kombinere et almindeligt føde- og vandadditiv, pholyphosphatsalte, med MXene materialer, forskere på Drexel har opdaget en måde at bremse oxidationsprocessen på, når de udsættes for vand. Kredi -
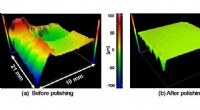 Gør en-krystal diamant klar til elektronikForm af mosaik-enkeltkrystal diamantsubstrat før og efter plasma-assisteret polering. Kredit:Osaka University Silicium har været elektronikkens arbejdshest i årtier, fordi det er et almindeligt el
Gør en-krystal diamant klar til elektronikForm af mosaik-enkeltkrystal diamantsubstrat før og efter plasma-assisteret polering. Kredit:Osaka University Silicium har været elektronikkens arbejdshest i årtier, fordi det er et almindeligt el
- Det digitale menneske:cyberversionen af menneskehedens søgen efter udødelighed
- Køretøjssikkerhed husker:Hvorfor førere ikke lytter til dem
- Hvis atomer for det meste er tomt rum, hvorfor ser og føles objekter så solide?
- Fransk tomatavler tager imod Monsanto over ukrudtsmiddel
- Forstå hvordan elektroner driver kemiske reaktioner
- Åbne relationer lige så tilfredsstillende som monogame, undersøgelse afslører


