Forstå hvordan elektroner driver kemiske reaktioner
1. Valenselektroner:Kemiske reaktioner involverer primært de yderste elektroner af atomer, kendt som valenselektroner. Disse elektroner holdes løst og er ansvarlige for at danne kemiske bindinger. Arrangementet og opførselen af valenselektroner bestemmer et atoms reaktivitet og dets tendens til at vinde eller tabe elektroner.
2. Elektronegativitet:Elektronegativitet er et mål for et atoms evne til at tiltrække elektroner mod sig selv. Atomer med høj elektronegativitet har en tendens til at trække elektroner væk fra naboatomer, hvilket skaber en ubalance i elektronfordelingen. Denne forskel i elektronegativitet mellem atomer driver dannelsen af kemiske bindinger.
3. Ionbinding:Ved ionbinding overføres elektroner fuldstændigt fra et atom til et andet, hvilket resulterer i dannelsen af positivt ladede ioner (kationer) og negativt ladede ioner (anioner). Tiltrækningen mellem modsat ladede ioner holder ionforbindelsen sammen.
4. Kovalent binding:Kovalent binding opstår, når atomer deler elektroner for at opnå en stabil elektronkonfiguration. I denne type binding overføres elektroner ikke, men deles snarere mellem atomer og danner en kovalent binding. Delingen af elektroner fører til dannelsen af molekyler.
5. Elektronparrepulsion:Elektronerne i et molekyle oplever frastødning på grund af deres negative ladninger. Denne frastødning påvirker den molekylære geometri og form. Ordningen af elektroner omkring atomer bestemmer vinklerne mellem bindinger og den overordnede molekylære struktur.
6. Oxidations-reduktionsreaktioner:Kemiske reaktioner involverer ofte overførsel af elektroner mellem atomer eller molekyler. Oxidation er tab af elektroner, mens reduktion er forstærkning af elektroner. Disse reaktioner forekommer samtidigt, hvor en art oxideres, mens en anden reduceres. Redoxreaktioner er essentielle i mange biologiske processer, såsom cellulær respiration og fotosyntese.
7. Energiniveauer og kvantemekanik:Elektroners opførsel i kemiske reaktioner kan forstås gennem kvantemekanik. Elektroner optager specifikke energiniveauer i et atom eller molekyle, og deres bevægelse mellem disse niveauer er forbundet med absorption eller frigivelse af energi. Kvantemekanik giver den teoretiske ramme for at forstå elektronadfærd og energien i kemiske reaktioner.
Ved at forstå, hvordan elektroner driver kemiske reaktioner, kan videnskabsmænd forudsige og forklare stoffers adfærd, designe nye materialer og udvikle innovative teknologier. Studiet af elektronadfærd er centralt for at fremme vores viden inden for kemi, fysik, biologi og andre beslægtede områder, der former vores forståelse af de grundlæggende processer, der styrer vores verden.
 Varme artikler
Varme artikler
-
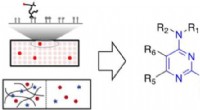 Bestemmelse af, hvad der binder til slimKredit:American Chemical Society Menneskekroppen er fuld af slim. Denne tyktflydende goo er ikke bare en gene, der bliver hostet eller nyset ud - det kan binde sig til medicin, toksiner eller mikr
Bestemmelse af, hvad der binder til slimKredit:American Chemical Society Menneskekroppen er fuld af slim. Denne tyktflydende goo er ikke bare en gene, der bliver hostet eller nyset ud - det kan binde sig til medicin, toksiner eller mikr -
 Svampespøgelser beskytter huden, stof fra toksiner, strålingSvampespøgelser skabes ved at ætse biologiske materialer fra svampeceller. Kredit:Nathan Gianneschi lab / Northwestern University Ideen om at skabe selektivt porøse materialer har fanget kemikeres
Svampespøgelser beskytter huden, stof fra toksiner, strålingSvampespøgelser skabes ved at ætse biologiske materialer fra svampeceller. Kredit:Nathan Gianneschi lab / Northwestern University Ideen om at skabe selektivt porøse materialer har fanget kemikeres -
 Kemikere udvikler et nyt miljøvenligt materiale til spildevandsrensningKredit:Allen Dressen RUDN -kemikere har udviklet en hybrid nanokatalysator til hurtig fjernelse af stabile organiske farvestoffer fra spildevand. Denne katalysator kræver ikke yderligere aggressiv
Kemikere udvikler et nyt miljøvenligt materiale til spildevandsrensningKredit:Allen Dressen RUDN -kemikere har udviklet en hybrid nanokatalysator til hurtig fjernelse af stabile organiske farvestoffer fra spildevand. Denne katalysator kræver ikke yderligere aggressiv -
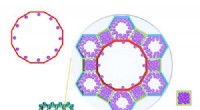 Realtidsanalyse af MOF-adsorptionsadfærdSkematisk illustration af molekyler adsorberet på metalorganiske rammer med forskellige porer af forskellige strukturer, hvor In-situ røntgenkrystallografi er blevet udviklet til at klassificere hver
Realtidsanalyse af MOF-adsorptionsadfærdSkematisk illustration af molekyler adsorberet på metalorganiske rammer med forskellige porer af forskellige strukturer, hvor In-situ røntgenkrystallografi er blevet udviklet til at klassificere hver
- Dechifrerer, hvordan kroppen vælger de rigtige opioide enantiomerer
- Smider lys over kometen Churs uventede kemiske kompleksitet
- Skoler beder eleverne om at medbringe digitale enheder til klassen, men bliver de faktisk brugt?
- Væsker får en glans til terahertz -stråling
- Dette drivhus kan ændre den måde, vi spiser på
- Omprogrammering af bakterier i stedet for at dræbe dem kunne være svaret på antibiotikaresistens


