Hvad er pH -værdien af ammoniumhydroxidopløsning?
Her er hvorfor:
* svag base: Ammoniumhydroxid (NH₄OH) ioniseres ikke helt i vand, hvilket betyder, at det ikke frigiver alle dets hydroxidioner (OH⁻). Dette er i modsætning til stærke baser som natriumhydroxid (NaOH), der ioniserer fuldt ud.
* ligevægt: Ioniseringen af ammoniumhydroxid er en ligevægtsreaktion:
NH₄OH (aq) ⇌ NH₄⁺ (aq) + OH⁻ (aq)
* Koncentration: Koncentrationen af hydroxidioner (OH⁻) i opløsning bestemmer pH. En højere koncentration af hydroxidioner resulterer i en højere pH (mere basisk).
For at bestemme den nøjagtige pH skal du kende koncentrationen af ammoniumhydroxidopløsningen og bruge ligevægtskonstanten (KB) til dens ionisering.
Fortæl mig, hvis du har koncentrationen og vil beregne pH.
Sidste artikelHvad er pH -værdien af aluminiumchlorid?
Næste artikelHvad er pH for ammoniumchlorid?
 Varme artikler
Varme artikler
-
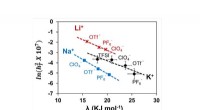 Ikke mere trial-and-error, når du vælger en elektrolyt til metal-luft-batterierDenne graf viser korrelationerne mellem tre parametre, der fører til en enkelt deskriptor, som giver et rationelt grundlag for at designe elektrolytsammensætninger til højeffekt alkalimetal-ilt-batter
Ikke mere trial-and-error, når du vælger en elektrolyt til metal-luft-batterierDenne graf viser korrelationerne mellem tre parametre, der fører til en enkelt deskriptor, som giver et rationelt grundlag for at designe elektrolytsammensætninger til højeffekt alkalimetal-ilt-batter -
 Hærens forskning lyser vejen for nye materialerUS Army Research Laboratory forskere Dr. David Baker og Dr. Joshua McClure poserer i deres laboratorium på Adelphi Laboratory Center, hvor de arbejder på at lette byrden og forbedre styrken af Soldi
Hærens forskning lyser vejen for nye materialerUS Army Research Laboratory forskere Dr. David Baker og Dr. Joshua McClure poserer i deres laboratorium på Adelphi Laboratory Center, hvor de arbejder på at lette byrden og forbedre styrken af Soldi -
 Biobaserede erstatninger til fossilt brændstofplastKredit:CC0 Public Domain BPA er en organisk forbindelse fremstillet af fossile brændstoffer. Det industrielle kemikalie er blevet brugt til at fremstille plast og harpiks siden 1950erne, og produk
Biobaserede erstatninger til fossilt brændstofplastKredit:CC0 Public Domain BPA er en organisk forbindelse fremstillet af fossile brændstoffer. Det industrielle kemikalie er blevet brugt til at fremstille plast og harpiks siden 1950erne, og produk -
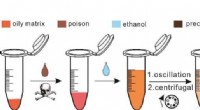 Ethanol-ekstraktion SERS-strategi giver meget følsom påvisning af giftstoffer i olieagtig matrixSkematisk diagram af SERS-detektion baseret på ethanolekstraktion. Kredit:WANG Yongtao Forskere fra det kinesiske videnskabsakademi (CAS) udviklede for nylig en ethanol-ekstraktionsoverfladeforstæ
Ethanol-ekstraktion SERS-strategi giver meget følsom påvisning af giftstoffer i olieagtig matrixSkematisk diagram af SERS-detektion baseret på ethanolekstraktion. Kredit:WANG Yongtao Forskere fra det kinesiske videnskabsakademi (CAS) udviklede for nylig en ethanol-ekstraktionsoverfladeforstæ
- Escape from Mars:Hvordan vand flygtede fra den røde planet
- Gør dyb læring hurtigere og enklere
- Hvilket stof har en bestemt form og volumen?
- Hvordan proteiner bliver indlejret i en cellemembran
- Var salt er organisk eller uorganisk?
- Formskiftende eksperiment udfordrer fortolkningen af, hvordan cadmiumkerner bevæger sig


