Hvilken masse SO2 produceres fra reaktionen 31,5G S8 og 8,65G O2?
1. Skriv den afbalancerede kemiske ligning:
Reaktionen mellem svovl (S8) og ilt (O2) producerer svovldioxid (SO2):
S8 + 8 O2 → 8 SO2
2. Beregn molen for hver reaktant:
* mol S8:
- Molmasse på S8 =256,52 g/mol
- mol S8 =(31,5 g) / (256,52 g / mol) =0,123 mol
* mol O2:
- Molmasse af O2 =32,00 g/mol
- mol O2 =(8,65 g) / (32,00 g / mol) =0,270 mol
3. Bestem den begrænsende reaktant:
Den begrænsende reaktant er den, der først bliver brugt op, hvilket begrænser mængden af produkt, der kan dannes. For at finde dette skal du sammenligne molforholdene fra den afbalancerede ligning:
* fra den afbalancerede ligning: 1 mol S8 reagerer med 8 mol O2.
* i vores reaktionsblanding: Vi har 0,123 mol S8 og 0,270 mol O2.
* forholdssammenligning: (0,123 mol S8) / (1 mol S8) =0,123
(0,270 mol O2) / (8 mol O2) =0,03375
Da forholdet for O2 er mindre, er O2 den begrænsende reaktant. Dette betyder, at mængden af SO2 produceret bestemmes af, hvor meget O2 der er tilgængelig.
4. Beregn molen af SO2 produceret:
Fra den afbalancerede ligning producerer 8 mol O2 8 mol SO2. Da O2 er den begrænsende reaktant, bruger vi dets mol til at beregne molen på SO2:
* Mol SO2 =(0,270 mol O2) * (8 mol SO2 / 8 mol O2) =0,270 mol SO2
5. Beregn massen af SO2 produceret:
* Molmasse på SO2 =64,07 g/mol
* Masse af SO2 =(0,270 mol SO2) * (64,07 g/mol) =17,3 g
Derfor produceres 17,3 g SO2 i denne reaktion.
Sidste artikelBeskriv, hvordan krystaller af kobbersulfat fremstilles?
Næste artikelHvad er produktet af ammoniumnitrat og calciumchlorid?
 Varme artikler
Varme artikler
-
 Enheden forfiner analysen af materialer til brændselsceller og batterierSkematisk af ny celle:(1) gevindlæbe; (2) blænde til gennemstrømning af stråling; (3) vindue; (4, 5, 17) O-ring; (6, 16) modelektrode; (7) cellelegemedel 1; (8) kammer til elektrolyt, modelektrode og
Enheden forfiner analysen af materialer til brændselsceller og batterierSkematisk af ny celle:(1) gevindlæbe; (2) blænde til gennemstrømning af stråling; (3) vindue; (4, 5, 17) O-ring; (6, 16) modelektrode; (7) cellelegemedel 1; (8) kammer til elektrolyt, modelektrode og -
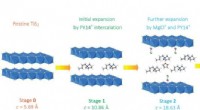 Gennembrud inden for magnesiumbatterier:Nanostruktureret katode, forståelse af ny elektrolyt fører…Skematisk over den strukturelle udvikling af titandisulfid på forskellige stadier af interkalation. Mellemlag udvides eller forvrænges som forskellige mængder af søjlemolekyler, komplekse kationer og
Gennembrud inden for magnesiumbatterier:Nanostruktureret katode, forståelse af ny elektrolyt fører…Skematisk over den strukturelle udvikling af titandisulfid på forskellige stadier af interkalation. Mellemlag udvides eller forvrænges som forskellige mængder af søjlemolekyler, komplekse kationer og -
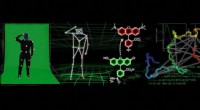 Kemikere udvikler motion capture-lignende teknologi til sporing af proteinformKredit:University of Pennsylvania I mange moderne animationsfilm, tricket til at opnå realistiske bevægelser for individuelle karakterer og objekter ligger i motion-capture teknologi. Denne proces
Kemikere udvikler motion capture-lignende teknologi til sporing af proteinformKredit:University of Pennsylvania I mange moderne animationsfilm, tricket til at opnå realistiske bevægelser for individuelle karakterer og objekter ligger i motion-capture teknologi. Denne proces -
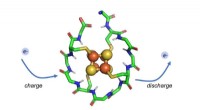 Forskere identificerer protein, der kan have eksisteret, da livet begyndteForskere har designet et syntetisk lille protein, der ombrydes omkring en metalkerne sammensat af jern og svovl. Dette protein kan gentagne gange oplades og udledes, gør det muligt for den at transpor
Forskere identificerer protein, der kan have eksisteret, da livet begyndteForskere har designet et syntetisk lille protein, der ombrydes omkring en metalkerne sammensat af jern og svovl. Dette protein kan gentagne gange oplades og udledes, gør det muligt for den at transpor
- Lydende raketmission for at give et øjebliksbillede af solens magnetfelt
- Hvordan asteroidestøv hjalp os med at bevise livets råingredienser kan udvikle sig i det ydre rum
- Hvad er et eksempel på oceanografi?
- Hvordan kan energi fra vulkaner gøres nyttige for mennesker?
- SpaceX-drage på vej til rumstation med NASA-videnskab, last
- Hvad er betydningen af kemi for samfundet og dagligdagen?


